Thermodynamische Systeme
In diesem Video zeigen wir dir einige wichtige Grundlagen hinsichtlich der Unterscheidungen verschiedener thermodynamischer Systeme.
Inhaltsübersicht
Einführung verschiedener Arten von thermodynamischen Systemen
Um die Grundlagen der Thermodynamik zu verstehen, überlegen wir uns als erstes, was thermodynamische Systeme sind. Per Definition ist das die Abgrenzung eines Bereichs für die thermodynamische Analyse, umschlossen von gedachten Systemgrenzen.
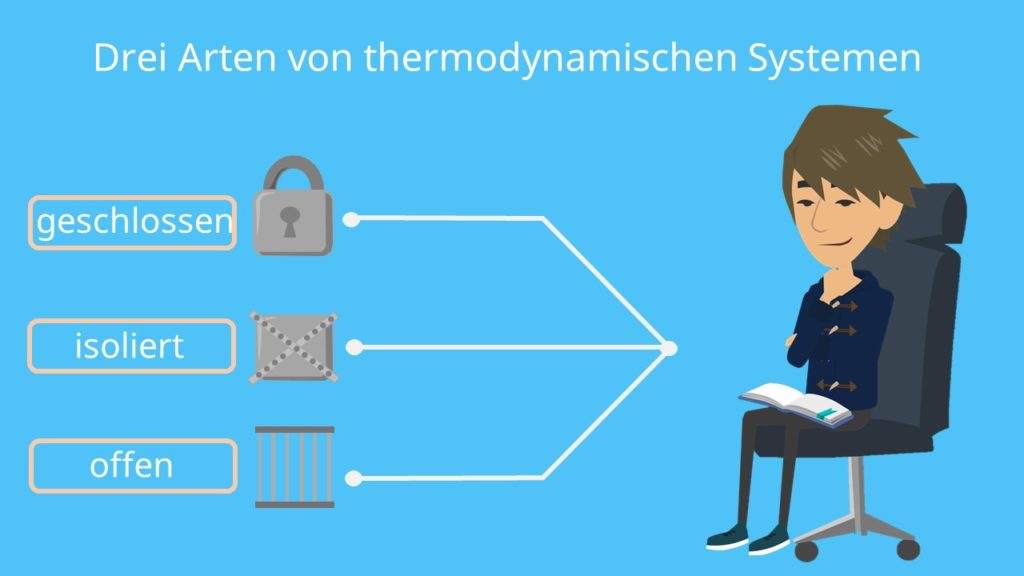
Bei der Wahl von thermodynamischen Systemen unterscheiden wir zwischen drei Arten: geschlossen, isoliert und offen.
Ein geschlossenes System
Das geschlossene System ist materieundurchlässig, lässt aber einen Energieaustausch zu – zum Beispiel in Form von Wärme. Du kannst dir dabei eine geschlossene Flasche Bier vorstellen. Wir können die Temperatur ändern, aber der Inhalt bleibt gleich.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Beispiel für ein abgeschlossenes System oder auch isoliertes System
Das isolierte System hingegen lässt weder einen Materie- noch einen Energieaustausch zu. Das ist der Fall, wenn du die Bierflasche isolierst und somit kein Wärmeaustausch mehr stattfinden kann. Hierbei handelt es sich eher um eine idealisierte Vorstellung, das eine hundertprozentige Abschottung in der Realität nicht möglich ist.
Umwandlung in ein offenes System
Sobald du die Bierflasche öffnest, entsteht eine Verbindung zu der Umgebung und es wird sowohl ein Materie- als auch ein Energieaustausch zugelassen. Dabei kann auch wieder Wärme aus der Umgebung aufgenommen beziehungsweise an die Umgebung abgegeben werden. Dies wird als offenes System bezeichnet. Außerdem bist du, als Mensch auch ein offenes System, da der menschliche Körper einen Wärmeaustausch mit seiner Umwelt durchführt.
Genauere Betrachtung der Systemgrenzen
Betrachten wir als Beispiel kochendes Wasser im Topf. Als thermodynamisches System können wir hier einfach das kochende Wasser selbst wählen und unsere Systemgrenzen darumlegen. Das können wir dann später thermodynamisch analysieren.
Du kannst dir bestimmt vorstellen, dass das System immer vom betrachteten Fall abhängt. Wenn wir Eier ins Wasser legen, können wir auch die Systemgrenzen um das Ei legen, falls uns das Ei mehr interessiert.
Unterscheidung von fluiden Phasen und Reinstoffen
Wir wissen jetzt also welche Systeme wir betrachten und wie wir sie abgrenzen können. Nun wollen wir diese Systeme aber noch beschreiben können. In der Regel betrachten wir fluide Phasen und sogenannte Reinstoffe.
Fluide Phasen sind flüssig oder gasförmig. Das heißt: alles, was sich zum Beispiel keiner Kuchenform anpasst, ist kein Fluid! Weiterhin zeichnen sich fluide Phasen dadurch aus, dass sie homogen verteilt und örtlich konstant sind. Bei kochendem Wasser nehmen wir also an, dass das Wasser überall „gleich“ kocht.
Definition von Reinstoffen in einem thermodynamischen System
Und was sind jetzt Reinstoffe? Das ist eigentlich ganz einfach. Reinstoffe bestehen nur aus einer Art von Atomen beziehungsweise Molekülen.
Bei einem Gas zum Beispiel nur aus Wasserstoff, oder nur aus Sauerstoff. Luft ist – im Gegensatz dazu – ein Gasgemisch aus Stickstoff, Sauerstoff, Wasserstoff und einigen anderen Gasen.
So, nun kannst du zwischen den verschiedenen thermodynamischen Systemen unterscheiden und weißt, wie du deine Systemgrenzen festlegen musst.