Gaskonstante
Dieser Artikel behandelt die Gaskonstante, die für ein ideales Gas angewendet werden kann. Sie ist auch unter dem Namen universelle Gaskonstante oder allgemeine Gaskonstante bekannt. Weiterhin wird auf die spezifische Gaskonstante von Luft eingegangen und ein Beispiel in Relation mit der allgemeinen Gasgleichung gerechnet.
Du willst nicht wieder so viel Text lesen? Unser Video erklärt dir die Gaskonstante anschaulich innerhalb kürzester Zeit!
Inhaltsübersicht
Gaskonstante Definition
Die Gaskonstante ist eine Proportionalitätskonstante, die hauptsächlich in der Thermodynamik verwendet wird. Diese kann unter anderem auch als universelle Gaskonstante, allgemeine Gaskonstante, ideale Gaskonstante oder molare Gaskonstante bezeichnet werden. Sie stellt einen wichtigen Teil zur Beschreibung eines idealen Gases für die allgemeine Gasgleichung dar.
Im Jahr 1811 führte der italienische Physiker und Chemiker Amadeo Avogadro empirisch Experimente durch. Dadurch stellte er fest, dass die Gaskonstante für alle idealen Gase denselben Wert besitzt. Diese Regel wurde bekannt als das „Gesetz von Avogadro“.
 ) oder zur Beschreibung der inneren Energie (
) oder zur Beschreibung der inneren Energie ( ) eines idealen Gases auf.
) eines idealen Gases auf.Der Artikel Fundamentalgleichungen der Thermodynamik beschreibt die Bedeutung und die Anwendung der inneren Energie näher.
Ideales Gas
Ein ideales Gas besteht aus sehr kleinen Teilchen, weshalb die Größe dieser Teilchen vernachlässigt werden kann. Sie können sich frei in einem definierten Volumen bewegen. Unter diesen Teilchen wirken keine Kräfte, jedoch kommt es zu elastischen Stößen zwischen den Teilchen untereinander und mit der Wand des Volumens. Wenn sich ein Teilchen geradlinig mit einer konstanten Geschwindigkeit bewegt, dann kann ein elastischer Stoß das Teilchen in eine andere Richtung lenken und dabei beschleunigen oder abbremsen.
Da jedoch zwischen unterschiedlichen Gasteilchen immer Kräfte herrschen, ist das ideale Gas nur eine Modellvorstellung. Wenn aber keine Stöße der Teilchen zugelassen werden würden, könnte man das Gas nicht in ein Volumen einsperren, da es die Wand nicht bemerken würde. Es ist also notwendig, dass das thermodynamische System geschlossen ist.
Außerdem würden die Teilchen dann die Anfangsgeschwindigkeit beibehalten. Somit wäre das System nicht in einem thermodynamischen Gleichgewicht, weshalb die thermodynamischen Hauptsätze hier nicht gelten würden.
Im Artikel Thermodynamische Systeme und Zustandsgrößen werden offene, geschlossene und isolierte Systeme beschrieben und voneinander abgegrenzt.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Gaskonstante berechnen
Die allgemeine Gaskonstante ist das Produkt aus der sogenannten Avogadro Konstante  und der Boltzmann Konstante
und der Boltzmann Konstante  und wird durch den Buchstaben
und wird durch den Buchstaben 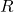 beschrieben.
beschrieben.
Die Avogadro Konstante gibt die Anzahl der Teilchen in einem Mol an, was genau  Teilchen entspricht. Diese Teilchen nehmen unter Normalbedingungen, also einer Temperatur von
Teilchen entspricht. Diese Teilchen nehmen unter Normalbedingungen, also einer Temperatur von 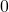 Grad Celsius und einem Druck von
Grad Celsius und einem Druck von  , mit der Einheit Pascal, ein Volumen von ca.
, mit der Einheit Pascal, ein Volumen von ca.  ein.
ein.
Mit der Boltzmann Konstante kann beschrieben werden, wie viel Energie ein Teilchen pro Kelvin besitzt. Mit ihr kann also zwischen absoluter Temperatur und Energie umgerechnet werden.

Spezifische Gaskonstante
Abgeleitet davon ergibt sich die sogenannte spezifische Gaskonstante  . Diese ist auch unter dem Namen individuelle Gaskonstante oder spezielle Gaskonstante bekannt. Dadurch kann durch Hinzunahme einer stoffspezifischen Größe, der molaren Masse, das
. Diese ist auch unter dem Namen individuelle Gaskonstante oder spezielle Gaskonstante bekannt. Dadurch kann durch Hinzunahme einer stoffspezifischen Größe, der molaren Masse, das 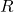 für jedes ideale Gas berechnet werden.
für jedes ideale Gas berechnet werden.
Spezifische Gaskonstante R Luft
Um die  von Luft zu berechnen, wird zuerst die molare Masse von Luft benötigt. Die molare Masse von trockener Luft beträgt
von Luft zu berechnen, wird zuerst die molare Masse von Luft benötigt. Die molare Masse von trockener Luft beträgt  . Somit ergibt sich die
. Somit ergibt sich die  als:
als:

Spezifische Gaskonstante Beispiel
Die spezielle Gaskonstante kann in der idealen Gasgleichung verwendet werden, um deren unterschiedliche Größen zu berechnen.
In dem Artikel Thermodynamische Zustandsgrößen und Grundgleichungen wird näher auf die ideale Gasgleichung eingegangen.
Zum besseren Verständnis ein Beispiel:
Ein mit Helium befülltes Gefäß besitzt ein Volumen von  und es herrscht ein Druck von
und es herrscht ein Druck von  MegaPascal. Wie groß ist die Masse des Gases bei einer Temperatur von
MegaPascal. Wie groß ist die Masse des Gases bei einer Temperatur von  Grad Celsius?
Grad Celsius?
Zunächst muss die Temperatur von Grad Celsius in Kelvin umgewandelt werden. Dazu wird auf den Celsius Wert die Zahl  addiert:
addiert:

Für Helium, das eine Molare Masse von ca.  besitzt, ergibt sich
besitzt, ergibt sich  zu:
zu:

Bekannt ist uns schon der thermodynamische Zusammenhang der Stoffmenge mit der Masse und der molaren Masse:

Dieser Zusammenhang wird im Artikel Thermodynamische Zustandsgrößen genauer betrachtet.
Außerdem lässt sich aus der Gleichung für die spezifische Gaskonstante folgende Gleichung umformen:

Diese Zusammenhänge können in die allgemeine Gasgleichung  eingesetzt werden. So lässt sich diese umschreiben zu:
eingesetzt werden. So lässt sich diese umschreiben zu:
 .
.
Durch Umformen entsteht der Zusammenhang:

Somit müssen die Werte nur noch eingesetzt werden und es ergibt sich eine Masse des Gases von:



