Adiabatische Zustandsänderung
Es gibt beliebig viele Zustandsänderungen, die ein thermodynamisches System durchlaufen kann. In diesem Beitrag betrachten wir die adiabatische Zustandsänderung.
Die Übersetzung des Begriffs „adiabat“ aus dem griechischen lautet „nicht hindurchtretend“ und verdeutlicht, dass keine Wärmeenergie mit der Umgebung ausgetauscht wird ( ). Das ist bei schnell ablaufenden Prozessen der Fall, z.B. bei Verbrennungsmotoren, bei denen pro Minute mehrere Tausend Kompressionen und Expansionen stattfinden. Eine andere Möglichkeit den Wärmeaustausch zu verhindern ist eine thermische Isolierung. Eine dritte Möglichkeit, wie reale Vorgänge adiabat ablaufen können ist, wenn das Volumen des Systems sehr groß ist und demnach die Wärmeströme am Rande des Systems vernachlässigt werden können. Laut Definition darf bei einer adiabatischen Zustandsänderung Energie nur mittels elektrischer, mechanischer oder magnetischer Arbeit dem System ab- bzw. zugeführt werden. Es darf im idealen Fall keine Wärmeleitung, Konvektion oder Wärmestrahlung stattfinden.
). Das ist bei schnell ablaufenden Prozessen der Fall, z.B. bei Verbrennungsmotoren, bei denen pro Minute mehrere Tausend Kompressionen und Expansionen stattfinden. Eine andere Möglichkeit den Wärmeaustausch zu verhindern ist eine thermische Isolierung. Eine dritte Möglichkeit, wie reale Vorgänge adiabat ablaufen können ist, wenn das Volumen des Systems sehr groß ist und demnach die Wärmeströme am Rande des Systems vernachlässigt werden können. Laut Definition darf bei einer adiabatischen Zustandsänderung Energie nur mittels elektrischer, mechanischer oder magnetischer Arbeit dem System ab- bzw. zugeführt werden. Es darf im idealen Fall keine Wärmeleitung, Konvektion oder Wärmestrahlung stattfinden.
Da kein Wärmeaustausch stattfindet, folgt aus dem 1. Hauptsatz der Thermodynamik :

Anders als bei der isochoren , isobaren und isothermen Zustandsänderung ändert sich hier jede Zustandsgröße, also die Temperatur, der Druck und das Volumen.
Inhaltsübersicht
Adiabatische Expansion und Kompression
Wir können unterscheiden in adiabatische Expansion und adiabatische Kompression.
Bei der Expansion wird das Volumen des Gases größer. Die innere Energie sinkt, da das Gas Arbeit verrichtet. In Folge dessen sinken auch die Temperatur und der Druck.
Bei der Kompression wird das Volumen des Gases verringert. Die innere Energie steigt, da durch die am Gas verrichtete Arbeit, dem System Energie zugeführt wird. Dadurch steigen auch Temperatur und Druck. Als Beispiel für die Kompression kann man sich eine Luftpumpe vorstellen. Die Arbeit, die an der Pumpe beim Aufblasen eines Fahrradreifens verrichtet wird, erhöht die innere Energie der Luft, womit die Temperatur steigt.
Reversible und irreversible adiabatische Zustandsänderung
Ein adiabatischer Prozess kann entweder als reversible oder als irreversible adiabatische Zustandsänderung ablaufen. Bei einer adiabaten Zustandsänderung findet kein Wärmeaustausch mit der Umgebung statt ( ).
).
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Reversible adiabatische Zustandsänderung
Die Entropie bleibt im reversiblen Fall konstant. Bei der reversiblen adiabaten Zustandsänderung spricht man auch von isentroper Zustandsänderung. Es gilt:

Für ideale Gase gilt:
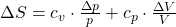
Mit 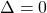 gilt:
gilt:

Womit sich folgende Gleichung ergibt:

Der Isentropen-Exponent Kappa beschreibt das Verhältnis der Wärmekapazitäten von Gasen bei konstantem Druck und bei konstantem Volumen. Er liegt je nach Gas und Temperatur zwischen 1,2 und 1,7. Integrieren wir die Differentialgleichung bei konstantem Kappa, dann lautet die Adiabatengleichung:

Für zwei beliebige Zustände gilt dann:

Irreversible adiabatische Zustandsänderung
Die Entropie bleibt bei der irreversiblen Zustandsänderung nicht konstant. Ein Beispiel für diese Form der adiabaten Zustandsänderung ist die Mischung von Gasen ohne Wärmetransport. Für die Entropieänderung gilt in diesem Fall:

Mit 
v = spezifische Volumina
V = absolute Volumina

Obwohl beim Mischen der Gase keine Wärme ausgetauscht wird, steigt die Entropie. Das liegt daran, dass die „Unordnung“ im Gesamtsystem größer wird.
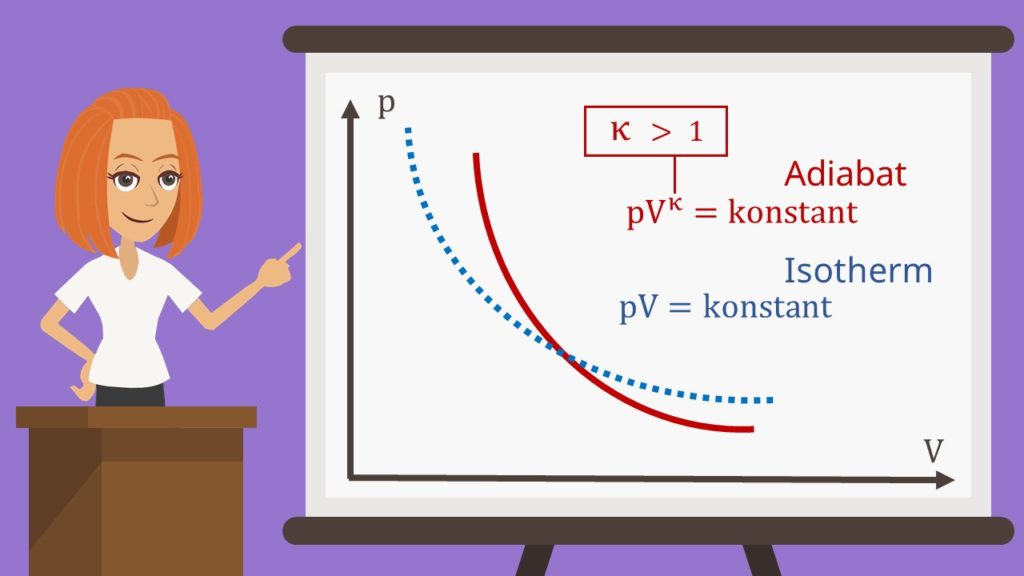
p-V-Diagramm
Schauen wir uns nun das p-V-Diagramm an. Vergleichen wir den Kurvenverlauf mit dem einer isothermen Zustandsänderung, dann fällt auf, dass der Verlauf deutlich steiler ist.
Der Grund dafür ist, dass der Exponent des Volumens größer als eins ist.
T-s-Diagramm
Als nächstes betrachten wir noch das T-s-Diagramm. Eine Entropieänderung liegt vor, wenn Wärmeenergie transportiert wird. Da dies beim adiabatischen Prozess nicht der Fall ist, ändert sich die Entropie auch nicht.
Was passiert nun beim irreversiblen adiabatischen Prozess? Betrachten wir einen Anfangszustand aus zwei Systemen, die jeweils im thermodynamischen Gleichgewicht sind. Die beiden Systeme werden als ein System zusammengesetzt. Bei der Verbindung der beiden Systeme, beispielsweise durch die Vermischung von zwei unterschiedlichen Gasen, wechselwirken diese miteinander.
Dabei laufen irreversible Wechselwirkungsprozesse ab. Es kommt zu einem Wärmeausgleich der Gase, bis beide dieselbe Temperatur haben. Dann kann man von einem neuen thermodynamischen Gleichgewicht sprechen. Genau wie beim reversiblen Prozess darf kein Wärmeaustausch mit der Umgebung stattfinden. Das kann zum Beispiel durch eine thermische Isolation verhindert werden. Der Unterschied zum reversiblen Prozess ist, dass der Endzustand nicht ohne weiteres wieder rückgängig gemacht werden kann und sich die Entropie ändert.
Fassen wir kurz zusammen was wir gelernt haben. Eine adiabatische Zustandsänderung läuft ohne Wärmetransport ab. Dadurch ist die Änderung der inneren Energie gleich der verrichteten Arbeit. Wir können unterscheiden zwischen reversiblen und irreversiblen adiabatischen Prozessen.