Salpetersäure
Die Salpetersäure ist eine stabile Säure. In diesem Beitrag lernst du alles über ihre Eigenschaften, Verwendung und Herstellung. Schau dir auch unser Video dazu an!
Inhaltsübersicht
Was ist Salpetersäure?
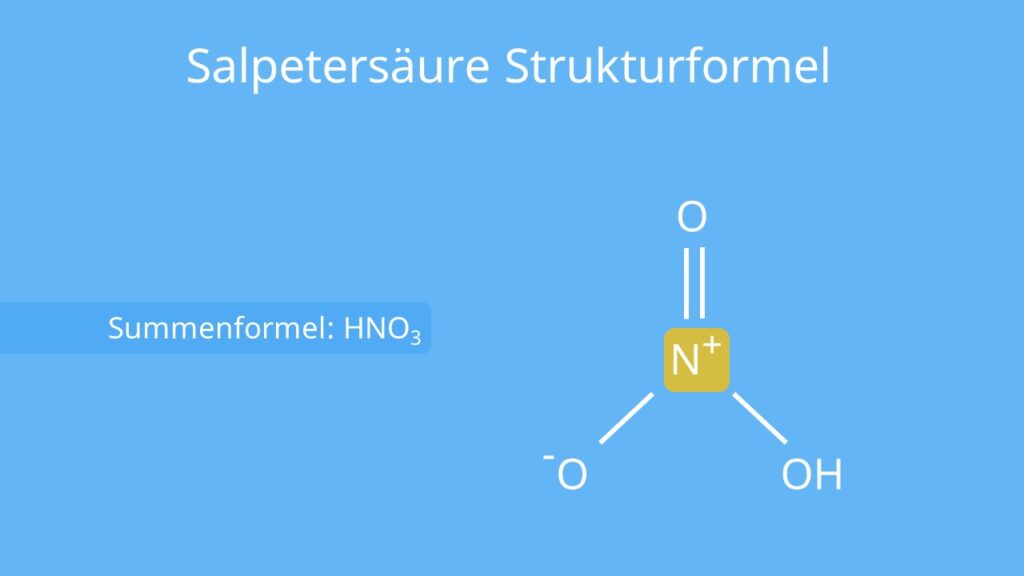
Die Salpetersäure (auch: Scheidewasser) ist eine stark ätzende Säure des Elements Stickstoff . Das bedeutet, dass die Säuregruppe (-OOH) nicht wie bei anderen Säuren, an ein Kohlenstoffatom (C), sondern an ein Stickstoffatom (N) gebunden ist. Das kannst du an der Strukturformel erkennen. Die Summenformel der Salpetersäure lautet HNO3.
In der Industrie wird die starke Säure hauptsächlich durch das sogenannte Ostwald-Verfahren gewonnen. HNO3 wird beispielsweise für die Herstellung von Spreng- und Farbstoffen oder Düngemitteln verwendet.
Eigenschaften Salpetersäure
Einige wichtige Eigenschaften der Säure haben wir dir in einem Steckbrief zusammengefasst:
| Salpetersäure Steckbrief | |
| Aussehen | farblose Flüssigkeit |
| Dichte | 1,513 g/cm3 |
| Löslichkeit | sehr gut in Wasser löslich |
| pKs-Wert | -1,377 (daher: starke Säure) |
| Siedepunkt | +83 °C |
| Schmelzpunkt | -41,6 °C |
| Besonderheiten |
|
Reaktionen der Salpetersäure
Im Folgenden wollen wir uns noch einige wichtige Reaktionen der Salpetersäure genauer ansehen:
Löslichkeit in Wasser
Da Salpetersäure (HNO3) eine sehr starke Säure ist, löst sie sich in Wasser vollständig auf, sodass Nitrat-Ionen (NO3–) und Oxonium-Ionen (H3O+) entstehen:
HNO3 + H2O 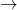 NO3– + H3O+
NO3– + H3O+
Rauchende Salpetersäure
Du unterscheidest zwischen unterschiedlichen Konzentrationen der Salpetersäure. Als konzentrierte Salpetersäure bezeichnest du eine 65- bis 69-prozentige Lösung der Salpetersäure in Wasser. Sie wird meist in Laboren verwendet. Nicht so häufig verwendet wird hingegen die 100-prozentige Lösung, die du auch rauchende Salpetersäure nennst.
Ist sie luftdicht verschlossen und kühl gelagert, handelt es sich zwar um eine farblose Flüssigkeit. Sobald die rauchende Säure aber mit Luft in Berührung kommt oder anfängt zu sieden, beginnt sie sich zu zersetzen. Dabei färbt sie sich orange, da das rotbraune, stark toxische Stickstoffdioxid (NO2) entsteht:
4 HNO3 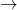 4 NO2 + 2 H2O + O2
4 NO2 + 2 H2O + O2
Schon gewusst? Ihren Namen trägt die rauchende Salpetersäure, da das entstehende Stickstoffdioxid-Gas wie orange-brauner Rauch aussieht.
Scheidewasser
Salpetersäure ist eine der stärksten Säuren. Sie kann sogar Edelmetalle wie Silber zersetzen. Der Name Scheidewasser kommt daher, dass man mit einer 50-prozentigen Lösung von Salpetersäure Silber aus Gold herauslösen kann. Du kannst Silber und Gold also durch die Säure trennen bzw. scheiden.
Königswasser
Konzentrierte Salpetersäure kann auch mit anderen Säuren, beispielsweise Salzsäure (HCl) reagieren. Auf die Weise kannst du sogenanntes Königswasser herstellen:
HNO3 + 3 HCl 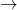 2 Cl + NOCl + 2 H2O
2 Cl + NOCl + 2 H2O
Im Königswasser entstehen dann Nitrosylchlorid (NOCl) und Chlor. Da Königswasser aus zwei starken Säuren besteht, kann es Verätzungen hervorrufen. Der Name Königswasser kommt daher, dass es edle Metalle wie Gold und Platin auflösen kann.
Salpetersäure Geschichte und Herstellung
Es gibt verschiedene Verfahren, mit denen die Salpetersäure hergestellt werden kann. Früher wurde sie vor allem mithilfe von Schwefelsäure und Nitraten hergestellt. Später wurde der sogenannte Lichtbogen zur Herstellung verwendet. Heute ist das sogenannte Ostwald-Verfahren die gängige Herstellungsart.
Herstellung mit Schwefelsäure und Nitrat
Die Salpetersäure wird schon seit dem Mittelalter hergestellt. Noch bis heute funktioniert die Herstellung der Salpetersäure, wie sie der Alchemist Johann Rudolph Glauber entdeckte. Und zwar kann Salpetersäure durch die Reaktion von Schwefelsäure (H2SO4) mit einem Salz der Salpetersäure, nämlich Kaliumnitrat (KNO3), hergestellt werden:
KNO3 + H2SO4 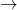 HNO3 + KHSO4
HNO3 + KHSO4
Neben der Salpetersäure entsteht noch Kaliumhydrogensulfat (KHSO4).
Statt Kaliumnitrat kannst du aber auch Natriumnitrat (NaNO3) mit Schwefelsäure reagieren lassen. Auch dann erhältst du Salpetersäure. Daneben entsteht außerdem Natriumhydrogensulfat (NaHSO4):
NaNO3 + H2SO4 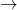 HNO3 + NaHSO4
HNO3 + NaHSO4
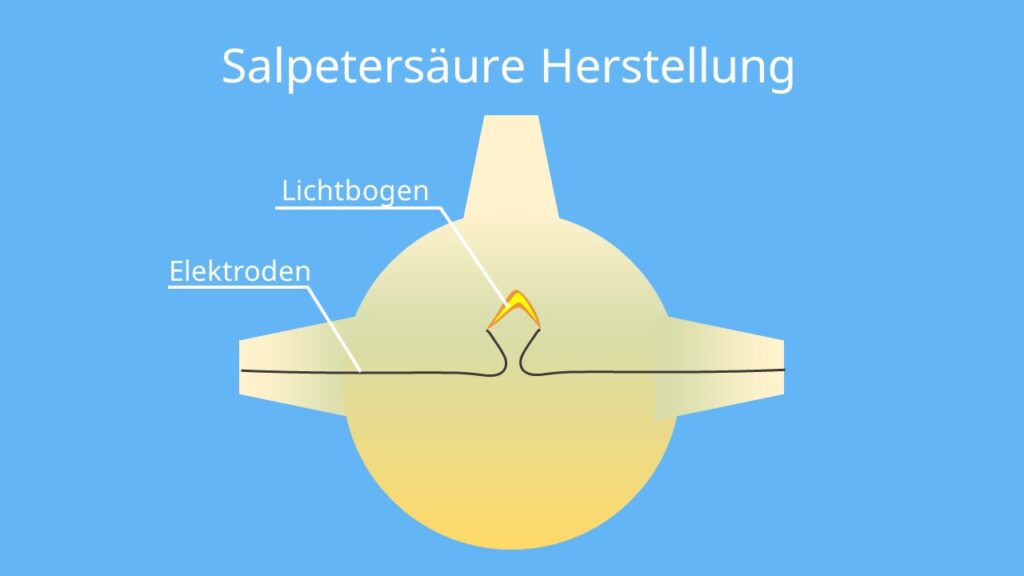
Herstellung mit Lichtbogen
1903 wurde vom Physiker Kristian Olaf Bernhard Birkeland und dem Ingenieur Sam Eyde ein Verfahren zur Herstellung von HNO3 entwickelt. Das Verfahren beruht auf einem Lichtbogen. Der entsteht, wenn du an zwei Elektroden in einer Glaskugel Hochspannung anlegst. Dabei reagieren die in der Luft enthaltenen Gase Stickstoff und Sauerstoff miteinander. Es bildet sich zunächst Stickstoffmonoxid (NO):
N2 + O2 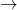 2 NO
2 NO
NO reagiert dann mit Sauerstoff weiter zu Stickstoffdioxid (NO2):
2 NO + O2 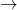 2 NO2
2 NO2
Stickstoffdioxid erkennst du in der Glaskugel sofort, da es orangebraun ist. Wenn du das entstandene NO2 mit Wasser reagieren lässt, entsteht schließlich HNO3:
3 NO2 + H2O 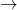 2 HNO3 + NO
2 HNO3 + NO
Da das Verfahren sehr viel Strom benötigt, wird es heute kaum noch angewendet. Stattdessen kannst du Salpetersäure heutzutage durch das Ostwald-Verfahren herstellen.
Salpetersäure Verwendung
Das Scheidewasser ist einer der wichtigsten Grundstoffe in der chemischen Industrie. Schauen wir uns am besten ein paar Beispiele für die Verwendung der Säure an:
- Synthesestoff: Salpetersäure dient unter anderem zur Herstellung von Düngemitteln, chemischen Verbindungen wie Phosphorsäure (H3PO4) oder Oxalsäure (C2H2O4), Farbstoffen (z. B. Azofarbstoffe) und Sprengstoffen wie Nitroglycerin (C3H5N3O9) oder Trinitrotoluol (TNT, C7H5N3O6).
- Schmuck: Hier wird HNO3 in Kombination mit Salzsäure (HCl) als Prüfsäure zur Bestimmung des Goldgehalts eingesetzt. Außerdem kann durch das Scheidewasser Silber von Gold getrennt werden.
- Raketen: In Raketentreibstoffen dient die Säure als Oxidationsmittel .
- Reinigungsmittel: Mit einem Reinigungsmittel kannst du beispielsweise Fette entfernen. Ist in dem Reinigungsmittel HNO3 enthalten, lassen sich die Fette leichter beseitigen. Das liegt daran, dass sie durch die Säure wasserlöslicher gemacht werden.
- Metalle: Die Säure kann einerseits zum Polieren von Metallen verwendet werden. Andererseits wird sie auch zum Beizen (Veränderung der Oberfläche) und Brennen von Metallen benutzt.
Nitrate: Salz der Salpetersäure
Wenn die Säure mit Metallen reagiert, entstehen Salze der Salpetersäure. Du nennst sie Nitrate.
Kupfernitrat
Reagiert Kupfer mit Salpetersäure, erhältst du Kupfer(II)-nitrat (Cu(NO3)2):
3 Cu + 8 HNO3 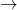 3 Cu(NO3)2 + 2 NO + 4 H2O
3 Cu(NO3)2 + 2 NO + 4 H2O
Zudem entstehen noch Wasser und Stickstoffmonoxid (NO).
Zinknitrat
Auch mit dem Metall Zink kann die Säure zu einem Nitrat, dem Zinknitrat (Zn(NO3)2), reagieren:
3 Zn + 8 HNO3 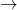 3 Zn(NO3)2 + 2 NO + 4 H2O
3 Zn(NO3)2 + 2 NO + 4 H2O
Auch hier entstehen wieder Wasser und Stickstoffmonoxid (NO).
Merke: Verwendest du für die Experimente konzentrierte Salpetersäure, lösen sich die beiden Metalle vollständig in der Säure auf.
Zusammenfassung
- Die Salpetersäure (HNO3), auch Scheidewasser genannt, ist eine starke Säure.
- Sie wirkt stark ätzend auf Augen, Haut und Schleimhäute.
- Bei der Salpetersäure wird zwischen verdünnter (12 %), konzentrierter (65-69 %) und rauchender Säure (100 %) unterschieden.
- In der Industrie wird die Salpetersäure mithilfe des Ostwald-Verfahrens hergestellt.
- Salpetersäure wird unter anderem verwendet, um Düngemittel und Sprengstoffe herzustellen.
Wie du bereits erfahren hast, bildet die Salpetersäure zusammen mit der Salzsäure das ätzende Königswasser. Schau dir als Nächstes unser Video zur Salzsäure an und finde heraus, wie die Säure aufgebaut ist und wofür sie sonst noch verwendet wird!