Protolyse
In diesem Artikel erklären wir dir alles, was du über die Protolyse und die Autoprotolyse wissen musst.
Um das Thema noch besser zu verinnerlichen, schau dir am besten auch unser Video zur Protolyse und Autoprotolyse an.
Inhaltsübersicht
Protolyse einfach erklärt
Bei einer protolytischen Reaktion wird ein Proton vom Protonendonator auf den Protonenakzeptor übertragen. Häufig findest du Beispiele für die Protolyse (auch Protolysereaktion genannt) bei den Säure-Base-Reaktionen. Bei der Protonenübertragungs-Reaktion stellt sich ein chemisches Gleichgewicht ein, das Protolysegleichgewicht. Die Autoprotolyse beschreibt die Eigendissoziation von Ampholyten. Ein typisches Beispiel dafür ist Wasser.
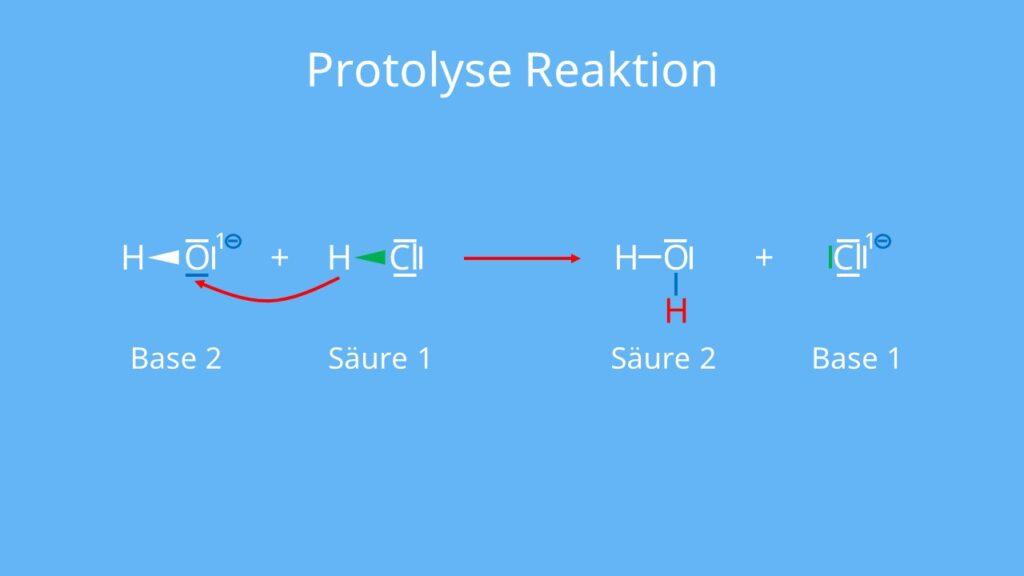
Die Protolyse ist eine Protonenübertragungs-Reaktion, bei welcher ein Proton (H+) von einem Reaktionspartner auf den anderen übertragen wird. Es stellt sich ein Protolysegleichgewicht ein.
Protolysereaktion
Bei der protolytischen Reaktion wird ein Proton von einem Reaktionspartner auf den anderen übertragen. Deshalb kannst du die Protolysereaktion auch Protonenübertragungs-Reaktion nennen. Vielleicht kommt dir dieses Konzept schon bekannt vor von der Säure-Base-Reaktion. Falls nicht kannst du hier unser Video zur Säuren und Basen finden. Bei der Protolysereaktion stellt sich ein Protolysegleichgewicht ein. Das kannst du dir so vorstellen: ein Proton wird übertragen und ein Teil dieser Protonen wird wieder zurück übertragen. Das passiert so lange bis ein gewisser Anteil protoniert vorliegt, während der restliche Teil unprotoniert ist. Während immer weiter Protonen übertragen werden, bleiben im Gesamtbild der protonierte und der unprotonierte Teil gleich. Das ist das Protolysegleichgewicht.
Damit du dir das besser vorstellen kannst, schauen wir uns das Beispiel der Reaktion von Salzsäure (HCl) mit Wasser (H2O) an:
HCl + H2O ⇌ Cl– + H3O+
Die Salzsäure gibt ein Proton ab, ist also der Protonendonator. Das Wasser kann das Proton aufnehmen und ist somit in diesem Fall der Protonenakzeptor.
Der Protonendonator gibt das Proton ab. In diesem Beispiel liegt das Gleichgewicht auf der rechten Seite. Die Salzsäure dissoziiert zu einem großen Teil. Bei starken Säuren und Basen kann eine vollständige Protolyse vorliegen. Das heißt, dass die komplette Säure dissoziiert, während bei schwachen Säuren und Basen die protolytische Reaktion nur teilweise abläuft.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Weitere Beispiele einer Protolyse
Hier siehst du noch weitere Beispiele zur Protolyse. Die Essigsäure (H3C–COOH) gibt ein Proton ab, ist also Protonendonator. Dementsprechend nimmt Wasser als Protonenakzeptor das Proton auf.
H3C–COOH + H2O ⇌ H3C–COO– + H3O+
Die Schwefelsäure (H2SO4) weist sogar 2 Dissoziationsschritte bzw. Protolysestufen auf. Zuerst wird ein Wassermolekül von der Schwefelsäure protoniert und anschließend das zweite Wassermolekül von der 1. Protolysestufe der Schwefelsäure, welche dann in der 2. Protolysestufe vorliegt. Schwefelsäure und deren erste Protolysestufe sind die Protonendonatoren. Wasser dient als Protonenakzeptor.
H2SO4 + 2 H2O ⇌ H3O+ + HSO4– + H2O ⇌ 2 H3O+ + SO42-
Beim folgenden Beispiel ist Ammoniak (NH3) der Protonenakzeptor, während Wasser diesmal als Protonendonator dient.
NH3 + H2O ⇌ NH4+ + OH–
Protonenakzeptor
Der Reaktionspartner, der das Proton aufnimmt, ist der Protonenakzeptor. In der Säuren und Basen Chemie sind das nach Brönsted (= Brønsted) und Lowry die Basen . Betrachtest du im Beispiel mit Salzsäure und Wasser die Teilreaktion der Protonenaufnahme, erhältst du die folgende Gleichung:
H+ + H2O ⇌ H3O+
Protonendonator
Der Protonendonator ist der Reaktionspartner, der das Proton abgibt. Nach Brönsted (= Brønsted) und Lowry ist der Protonendonator die Säure . Für die Teilreaktion der Protonenabgabe aus dem Beispiel Salzsäure und Wasser ergibt sich dann diese Gleichung:
HCl ⇌ Cl– + H+
Autoprotolyse
Die Autoprotolyse , welche auch Eigendissoziation genannt wird, kannst du bei Ampholyten beobachten, wie zum Beispiel bei Wasser. Ein Wassermolekül kann ein Proton auf ein anderes Wassermolekül übertragen. Es ist also eine Protolyse von Wasser mit sich selbst:
H2O + H2O ⇌ H3O+ + OH–
Bei der Autoprotolyse von Wasser entstehen Oxonium- (H3O+) und Hydroxidionen (OH–). Du kennst diesen Vorgang womöglich bereits unter dem Ionenprodukt des Wassers
. Das Ionenprodukt des Wassers  ist die Anwendung des Massenwirkungsgesetz auf die Autoprotolyse von Wasser.
ist die Anwendung des Massenwirkungsgesetz auf die Autoprotolyse von Wasser.

Das Gleichgewicht von der Autoprotolyse des Wassers variiert je nach Temperatur. Als Folge beeinflusst die Autoprotolyse des Wassers also auch den pH-Wert . Bei Raumtemperatur ist der pH-Wert von Wasser bekanntermaßen 7,0. Doch bei höherer Temperatur wird Wasser sauer, also der pH-Wert geringer, während bei niedrigerer Temperatur Wasser basisch wird. Der pH-Wert steigt.
Protolyse in nichtwässrigen Lösungen
Auch in nichtwässrigen Lösungen kann Protolyse stattfinden. Bei diesen Stoffen kann man ebenfalls Autoprotolyse beobachten. Ein typisches Beispiel ist Ammoniak:
NH3 + NH3 ⇌ NH4+ + NH2–
Schwefelsäure hatten wir weiter oben bereits als Beispiel genannt. Diese kann jedoch auch Autoprotolyse betreiben:
H2SO4 + H2SO4 ⇌ H3SO4+ + HSO4–