pKs Wert
In diesem Beitrag, erfährst du alles wichtige über den pKs Wert. Du erlernst, wie er definiert ist, was er über die Stärke einer Säure aussagt und wie man ihn berechnen kann.
Falls dir ein Video zum Lernen solcher Themen eher zusagt, dann können wir dir ebenfalls hier weiterhelfen.
Inhaltsübersicht
pKs Wert einfach erklärt
Der pKs Wert (im Englischen pKa Wert für a = acid) ist eine Stoffkonstante, welcher die Stärke einer Säure beschreibt.
Er ist definiert als negativer dekadischer Logarithmus der Säurekonstanten.

Letztere wird über das Massenwirkungsgesetz definiert und dementsprechend anhand der Stoffmengenkonzentrationen der Reaktionsteilnehmer einer Gleichgewichtsreaktion berechnet.
pKs Wert berechnen
Um die Berechnung zu verstehen, leiten wir uns zunächst einmal die Formel über das Massenwirkungsgesetz her. Betrachten wir hierfür zuerst eine allgemeine Säure-Base-Reaktion in wässriger Lösung:
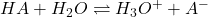
Wenn du nun das Massenwirkungsgesetz anwendest, erhältst du die Formel für die Gleichgewichtskonstante  :
:

Da sich diese Größe im chemischen Gleichgewicht nicht verändert und die Konzentration des Wassers praktisch konstant bleibt, fasst man die Werte zu einer neuen Größe zusammen: der Säurekonstanten  .
.

Wendest du nun den negativen Zehnerlogarithmus an, wie in der ersten Formel, erhältst du die ausführliche Formel zum  -Wert:
-Wert:

Je nachdem wie hoch der  -Wert ist, klassifizierst du eine Säure als stark, mittelstark oder schwach. Für die Berechnung der Werte von Säuren der entsprechenden Kategorien existieren mathematische Vereinfachungen, die auf gewissen Annahmen beruhen.
-Wert ist, klassifizierst du eine Säure als stark, mittelstark oder schwach. Für die Berechnung der Werte von Säuren der entsprechenden Kategorien existieren mathematische Vereinfachungen, die auf gewissen Annahmen beruhen.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Starke Säuren
Generell entstehen bei der Dissoziation einer Säure immer genauso viele Oxonium-Ionen wie Ionen der korrespondierenden Base. Aus diesem Grund können wir die Gleichung für den pKs Wert ein wenig vereinfachen.


Nun gibt es diverse Säuren, wie etwa Bromwasserstoffsäure  und Salzsäure
und Salzsäure  , die in wässrigen Lösungen bereits zu 100% dissoziieren. Also hat die Säure im chemischen Gleichgewicht eine Konzentration von etwa
, die in wässrigen Lösungen bereits zu 100% dissoziieren. Also hat die Säure im chemischen Gleichgewicht eine Konzentration von etwa  . Du fragst dich nun sicher, wie man dennoch unterschiedliche
. Du fragst dich nun sicher, wie man dennoch unterschiedliche  –Werte für derartige Säuren in der Literatur finden kann (
–Werte für derartige Säuren in der Literatur finden kann ( ;
;  ). Schließlich darf man die obige Gleichung mathematisch gesehen gar nicht anwenden.
). Schließlich darf man die obige Gleichung mathematisch gesehen gar nicht anwenden.
Um solche  -Werte zu ermitteln, beobachtet man das Verhalten dieser Säuren in anderen Lösemitteln als Wasser. So kannst du beispielsweise eine schwächere Säure als Lösemittel nutzen und herausfinden, dass die Salzsäure in dieser Lösung zu einem geringerem Maße dissoziiert als die Bromwasserstoffsäure. Und schon hast du bemerkt, welche die stärkere der beiden Säuren ist.
-Werte zu ermitteln, beobachtet man das Verhalten dieser Säuren in anderen Lösemitteln als Wasser. So kannst du beispielsweise eine schwächere Säure als Lösemittel nutzen und herausfinden, dass die Salzsäure in dieser Lösung zu einem geringerem Maße dissoziiert als die Bromwasserstoffsäure. Und schon hast du bemerkt, welche die stärkere der beiden Säuren ist.
Mittelstarke Säuren
Bei mittelstarken Säuren in wässriger Lösung wird nur ein Teil der Säure in Oxonium–Ionen überführt. Ein relevanter Anteil an Säuremolekülen verbleibt also im chemischen Gleichgewicht. Aus diesem Grund kannst du die Näherung, die wir für die schwachen Säuren nutzen, hier nicht anwenden.
Da im Rahmen der Gleichgewichtsreaktion genauso viele  –Ionen entstehen wie Säuremoleküle dissoziieren, kannst du die Konzentration der Oxonium–Ionen von der anfänglichen Säurekonzentration subtrahieren. Auf diese Weise erhältst du den Konzentrationswert der Säure im chemischen Gleichgewicht.
–Ionen entstehen wie Säuremoleküle dissoziieren, kannst du die Konzentration der Oxonium–Ionen von der anfänglichen Säurekonzentration subtrahieren. Auf diese Weise erhältst du den Konzentrationswert der Säure im chemischen Gleichgewicht.


Wenn du den pKs Wert ermittelt hast, könntest du nun, mithilfe der Henderson Hasselbalch Gleichung , den pH Wert von mittelstarken Säuren ebenfalls berechnen.
pKb Wert
Korrespondierend zum pKs Wert, der dir die Stärke einer Säure angibt, existiert der pKb Wert, welcher die Stärke von Basen beziffert. Dieser ist analog dazu als negativer dekadischer Logarithmus der Basenkonstante 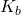 definiert.
definiert.

Letzteren kannst du ebenfalls anhand einer allgemeinen Säure-Base-Reaktionsgleichung in wässriger Lösung mithilfe des Massenwirkungsgesetzes herleiten. Diesmal beachtest du allerdings die Konzentration an Hydroxid-Ionen.



Es existiert zwischen dem pKs Wert einer Säure und dem pKb Wert einer Base ein besonderer Zusammenhang, welcher ersichtlich wird, wenn du die Säurekonstante mit der Basenkonstanten multiplizierst.
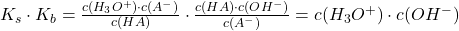
Das letzte Produkt ist bekannt als Ionenprodukt des reinen Wassers  , da das Wasser durch Autoprotolyse sowohl Oxonium– als auch Hydroxidionen enthält. Eine Besonderheit hierbei ist, dass die Aktivitäten beider Ionensorten bei 25°C jeweils
, da das Wasser durch Autoprotolyse sowohl Oxonium– als auch Hydroxidionen enthält. Eine Besonderheit hierbei ist, dass die Aktivitäten beider Ionensorten bei 25°C jeweils  , das Produkt somit
, das Produkt somit  entspricht. Für die Konzentrationen bedeutet dies nun folgenden Zusammenhang:
entspricht. Für die Konzentrationen bedeutet dies nun folgenden Zusammenhang:

Wendest du nun den negativen Zehnerlogarithmus an um aus der Säuren- bzw. Basenkonstanten den pKs und pKb Wert zu erhalten und beachtest zusätzlich die Rechenregel zum Logarithmus von Produkten und Potenzen, so ergibt sich die nächste Gleichung:

Damit erkennst du, dass du anhand des  -Wertes einer Säure, den
-Wertes einer Säure, den  -Wert der korrespondieren Base errechnen kannst und umgekehrt.
-Wert der korrespondieren Base errechnen kannst und umgekehrt.
pKs Tabelle
Um dir einen kurzen Überblick zu den pKs Werten gängiger Säuren und den pKb Werten der korrespondierenden Basen zu verschaffen, kannst du die folgende Tabelle betrachten. Anhand der einzelnen Kategorien an den Rändern kannst du somit beurteilen, welche Formel du für die Berechnung des pKs Wertes anwenden musst.
| Säurestärke | pKs | Säure | Base | pKb | Basenstärke |
| sehr stark | −17 | H[SbF6] | [SbF6]− | 31 | sehr schwach |
| −10 | HClO4 | ClO4− | 24 | ||
| −10 | HI | I− | 24 | ||
| −8,9 | HBr | Br− | 22.9 | ||
| −6 | HCl | Cl− | 20 | ||
| −3 | H2SO4 | HSO4− | 17 | ||
| −1,32 | HNO3 | NO3− | 15.32 | ||
| stark | 0 | H3O+ | H3O | 14 | schwach |
| 1.92 | HSO4− | SO42− | 12.08 | ||
| 2.13 | H3PO4 | H2PO4− | 11.87 | ||
| 2.22 | [Fe(H2O)6]3+ | [Fe(OH)(H2O)5]2+ | 11.78 | ||
| 3.14 | HF | F− | 10.86 | ||
| 3.75 | HCOOH | HCOO− | 10.25 | ||
| mittelstark | 4.75 | CH3COOH | CH3COO− | 9.25 | mittelstark |
| 4.85 | [Al(H2O)6]3+ | [Al(OH)(H2O)5]2+ | 9.15 | ||
| 6.52 | H2CO3 | HCO3− | 7.48 | ||
| 6.92 | H2S | HS− | 7.08 | ||
| 7.2 | H2PO4− | HPO42− | 6.8 | ||
| schwach | 9.25 | NH4+ | NH3 | 4.75 | stark |
| 9.4 | HCN | CN− | 4.6 | ||
| 9.8 | C3H10N+ | C3H9N | 4.2 | ||
| 10.4 | HCO3− | CO32− | 3.6 | ||
| 10.6 | CH6N+ | CH5N | 3.4 | ||
| 10.73 | C2H8N+ | C2H7N | 3.27 | ||
| 12.36 | HPO42− | PO43− | 1.64 | ||
| 13 | HS− | S2− | 1 | ||
| 14 | H2O | OH− | 0 | ||
| sehr schwach | 15.9 | CH3-CH2-OH | CH3-CH2-O− | −1,90 | sehr stark |
| 23 | NH3 | NH2− | −9 | ||
| 48 | CH4 | CH3− | +34 |
Ursachen unterschiedlicher Säurestärken
Nun hast du verstanden, dass es verschieden starke Säuren gibt und wie du diese bezifferst. Aber aus welchen Gründen unterscheidet sich die Säurestärke von Molekülen? Generell ist gibt eine starke Säure ein Proton leicht an die Umgebung ab. Auf dieses Verhalten gibt es mehrere Einflussgrößen.
So ist eine Säure stärker, je instabiler das Säuremolekül oder je stabiler bzw. schwächer die korrespondierende Base ist.
Bei Atomen gleicher Größe wird die Säurestärke außerdem erhöht, wenn das elektronegativere Atom das dissoziierbare Wasserstoffatom trägt. Falls das Säuremolekül über Atome unterschiedlicher Größe verfügt und sich das Wasserstoffatom bei größeren Atomen befindet, verringert dies ebenfalls den pKs Wert.
Darüber hinaus steigert ein vorhandener -I-Effekt, also ein induktiver Elektronenzug, die Säurestärke ebenfalls. Letztere wird zusätzlich erhöht, je niedriger die Standardbildungsenthalpie der korrespondierenden Base ist.

