Säuren und Basen
Für Säuren und Basen gibt es mehrere Definitionen. In diesem Beitrag gehen wir näher auf deren Eigenschaften und Reaktionen ein.
Du möchtest dir das Thema lieber erklären lassen? Dafür haben wir dir hier ein Video erstellt.
Inhaltsübersicht
Säuren und Basen Chemie einfach erklärt
In der Chemie gibt es verschiedene Begriffsdefinitionen der Säuren und Basen. Die gängigste Definition, welche du auch in der Schule kennengelernt hast, ist die von Johannes Brønsted und Thomas Lowry. Sie definiert Säuren als Teilchen, die Protonen an andere Teilchen den Basen abgeben können. Somit gibt die Säure Protonen ab und eine Base nimmt Protonen auf.
Säuren sind Protonendonatoren und Basen sind Protonenakzeptoren.
Basen und Säuren
Ein Proton wird in der Chemie häufig als H+ dargestellt. Das ist das Kation des Wasserstoffs. Wird ein Elektron von dem normalen Wasserstoff entfernt, so bleibt nur noch das Proton im Atomkern übrig. Das ist der Grund, weshalb das Kation auch als Proton bezeichnet wird.
Für Reaktionsgleichungen von Säuren und Basen nach Brønsted und Lowry bedeutet das nichts anderes als, dass Säuren Wasserstoff-Ionen abgeben und Basen Wasserstoff-Ionen aufnehmen möchten.
Als Merkhilfe kannst du dir vorstellen, dass Säuren sauer sind und deshalb ihre Protonen nicht mehr haben wollen und abgeben. Wichtig ist aber, dass die Abgabe nur stattfindet, wenn das Proton eine Base aufnimmt. Ein freies Proton ist sehr reaktiv und kann aus dem Grund nur abgegeben werden, wenn es woanders aufgenommen werden kann.
Mit dieser Definition gilt folgende Gleichgewichtsreaktion:
Säure ⇌ Base + Proton
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Säure Base Reaktion
Bei einer Säure Base Reaktion, reagiert, wie der Name schon sagt eine Säure mit einer Base. Wir schauen uns jetzt das Ergebnis von einer solchen Reaktion an.
Eine Brønsted-Säure stellt man mit der Abkürzung HA und eine Base mit B dar.
Bei einer Säure Base Reaktion reagiert die Säure HA zu ihre korrespondierende Base A– und eine Base B wird zu ihrer korrespondierenden Säure HB+. An der allgemeinen Darstellung kannst du sehen, dass ein Proton H+ von der Säure zur Base übergeht.
Schauen wir uns eine Beispielreaktion von Salzsäure (HCl) mit Wasser (H2O) an:
HCl + H2O ⇌ Cl– + H3O+
Hier ist HCl die Säure und Wasser die Base. Diese Reaktion lässt sich jetzt in zwei Teilreaktionen aufteilen, die auch zusammen als Protolyse bezeichnet werden. Einmal in die Protonenabgabe und einmal in die Protonenaufnahme:
- Protonenabgabe: HCl → Cl– + H+
- Protonenaufnahme: H2O + H+ → H3O+
HCl gibt sein Proton ab und wird dadurch zu Cl–. Dieses Proton reagiert nun mit Wasser zu einem Hydronium-Ion H3O+.
Wir haben dir ein paar Säuren und Basen mit ihren jeweiligen Gegenionen gesammelt:
| Name | Summenformel | Gegenion |
| Flusssäure | HF | F– |
| Salpetersäure | HNO3 |  |
| Salpetrige Säure | HNO2 | 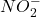 |
| Phosphorsäure | H3PO4 |  |
| Kohlensäure | H2CO3 |  |
| Salzsäure | HCl | Cl– |
| Schwefelsäure | H2SO4 |  |
| Schwefelwasserstoff | H2S | S2- |
| Ammoniak | NH3 |  |
| Kaliumhydroxid | KOH | K+ |
| Natriomhydroxid | NaOH | Na+ |
Um herauszufinden, ob eine Säure stark sauer ist kann man sich den pKS-Wert anschauen. Dieser Wert gibt an wie stark das Bestreben der Säure ist, ein Proton abzugeben und ist auf die Säurekonstante zurückzuführen, die für jede Säure anders ist. Analog gibt es für Basen einen pKB-Wert der von der jeweiligen Basenkonstante abhängig ist.
Bei Säuren bedeutet ein niedriger pKS-Wert, dass die Säure stark sauer ist. Für Basen ist das genau andersrum. Je niedriger der pKB-Wert, desto stärker ist die Base.
Nun zum charakteristischen pH Wert . Dieser gibt an wie sauer oder basisch sich eine Lösung verhält und damit auch wie viele Hydronium- bzw. Hydroxid-Ionen in dieser vorhanden sind. Der pH-Wert hat keine Einheit und ist auf einer logarithmischen Skala von 0 bis 14 definiert. 7 bedeutet dabei, dass eine Lösung neutral ist und weder Säure- noch Basencharakter aufweist. Da die Skala dem Zehnerlogarithmus folgt, bedeutet das, dass eine Säure mit pH-Wert 4 bereits 10-mal saurer ist, als eine Säure mit pH-Wert 5. Und sogar 100-mal saurer als eine Säure mit pH-Wert 6.
Wasser ist neutral und hat den pH-Wert 7 und Cola beispielsweise 2,5. Für Fische – und auch für alle anderen Lebewesen – können zu viele Hydronium- bzw. Hydroxid-Ionen schädlich sein.
Neutralisation
Genauso wie sich zwei gleichstarke Kräfte aufheben können, können sich eine Säure und eine Base gegenseitig ausgleichen, wenn sie gleich stark sind. Mischt man zum Beispiel zu gleichen Teilen Salzsäure und Natronlauge zusammen, entsteht dabei eine neutrale Kochsalzlösung mit einem pH-Wert von 7. Diesen Vorgang nennt man Neutralisation.
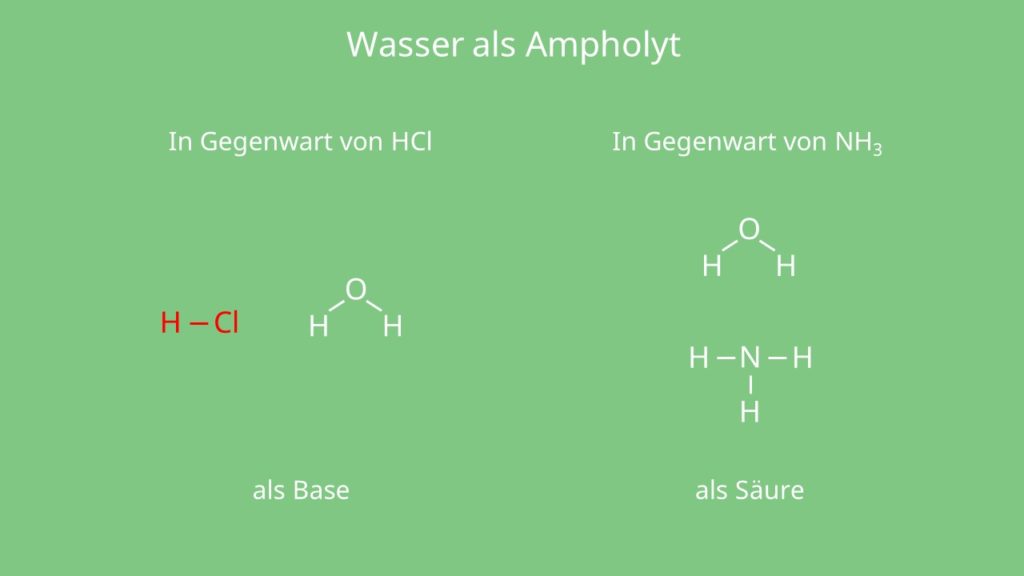
Ampholyte
Es gibt ein paar chemische Stoffe, die sich sowohl als Base oder auch Säure verhalten. Zum Beispiel die Schwefelsäure H2SO4 , Wasser H2O und Ammoniak NH3. Diese werden dann auch als Ampholyte bezeichnet.
In Gegenwart von Salzsäure verhält es sich als Base und nimmt ein Proton auf, aber in Gegenwart von Ammoniak gibt Wasser ein Proton ab und zeigt somit Säure-Charakter.
Autoprotolyse
Ampholyte können mit sich selbst reagieren. Ein solcher Stoff besitzt die Fähigkeit zur Eigendissoziation. Das bedeutet, dass sich die H2O-Moleküle selbst in Hydronium– und Hydroxidionen zersetzen. Hierbei wandern dann Protonen von einem Wassermolekül zum anderen und bilden somit ein Hydroxidion und ein Hydronium-Ion. Die Eigendissoziation bezeichnet man auch als Autoprotolyse. Sie ist der Grund dafür, dass auch destilliertes Wasser schwach elektrisch leitend ist.
Die Autoprotolyse von Wasser ist dabei folgende Gleichgewichtsreaktion:
H2O + H2O ⇌ H3O+ + OH–