pH Wert berechnen
Der Begriff pH Wert ist dir nicht unbekannt und du willst wissen, wie du ihn berechnen kannst? Dann bist du hier genau richtig! Wir zeigen dir anhand von Beispielen, wie du den pH Wert für starke Säuren oder schwache Säuren berechnen kannst.
Wenn du das Ganze lieber kurz in einer audiovisuellen Fassung anschauen möchtest, dann schau dir gerne unser Video an!
Inhaltsübersicht
pH Wert Definition
Zuerst noch einmal kurz dazu, was der pH-Wert beschreibt.
 in der Lösung ist.
in der Lösung ist.Der pH Wert stellt genau diese Konzentration dar, jedoch in der Form eines negativen, dekadischen Logarithmus:

Dabei wurde weiterhin definiert, dass alle Konzentrationen, die größer sind als die übliche Konzentration der  Ionen im Wasser (
Ionen im Wasser (  ) bei 25ºC ein saures Milieu erzeugen und kleinere Konzentrationen ein basisches Milieu. Also erzeugt ein pH Wert kleiner 7 ein saures und ein pH Wert größer 7 ein basisches Milieu.
) bei 25ºC ein saures Milieu erzeugen und kleinere Konzentrationen ein basisches Milieu. Also erzeugt ein pH Wert kleiner 7 ein saures und ein pH Wert größer 7 ein basisches Milieu.
pH Wert berechnen starke Säuren
Die Konzentration der Oxoniumionen  kann man durch Zugabe verschiedener Basen und Säuren beeinflussen. Wenn du nicht mehr ganz sicher bist, wie das geht, dann schau doch nochmal das Grundlagen-Video zum Thema Säure-Base-Reaktion hier
an.
kann man durch Zugabe verschiedener Basen und Säuren beeinflussen. Wenn du nicht mehr ganz sicher bist, wie das geht, dann schau doch nochmal das Grundlagen-Video zum Thema Säure-Base-Reaktion hier
an.
Die Säuren kann man dabei in starke und schwache Säuren unterteilen, je nachdem wie weit das folgende chemische Gleichgewicht auf der Produktseite liegt, beziehungsweise wie stark die Säure dissoziiert in der Lösung vorliegt:

Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
pH Wert berechnen starke Säuren Formel
Bei sehr starken Säuren liegt dabei das Gleichgewicht komplett auf der dissoziierten Produktseite. Dies gilt nur für Säuren, die einen pKs-Wert
von kleiner 1 haben. Das gilt zum Beispiel für Salzsäure und Schwefelsäure. Wenn man berechnen will, wie hoch nach Zugabe einer starken Säure der pH Wert dieser Lösung ist, nimmt man an, dass die Säure komplett mit dem Wasser reagiert hat und damit nur noch als korrespondierende schwache Base in der Lösung vorliegt. Unter dieser Annahme kann man dann davon ausgehen, dass die neue Konzentration der Oxonium-Ionen  im Wasser der vorherigen Konzentration der Säure in der Lösung entspricht:
im Wasser der vorherigen Konzentration der Säure in der Lösung entspricht:

Dabei wird auch auch das Auto-Protolyse
Gleichgewicht vernachlässigt, durch das normalerweise im Wasser schon eine geringe Konzentration der Oxonium-Ionen ( ) vorliegt. Unter diesen beiden vereinfachenden Annahmen kann man den pH Wert einfach durch logarithmieren und Vorstellen eines Minuszeichen berechnen:
) vorliegt. Unter diesen beiden vereinfachenden Annahmen kann man den pH Wert einfach durch logarithmieren und Vorstellen eines Minuszeichen berechnen:

pH Wert berechnen starke Säuren Beispiel
Die nun hergeleitete Formel kann man nun einfach in praktischen Situationen anwenden. Dazu nehme man beispielhaft an, man hat eine wässrige Lösung von Salzsäure ( ) vorliegen. wobei die Konzentration von
) vorliegen. wobei die Konzentration von  1mol/l ist. Nun möchte man wissen, wie hoch der pH-Wert dieser Lösung ist. Dafür schlägt man zuerst den pKs-Wert
der Salzsäure nach:
1mol/l ist. Nun möchte man wissen, wie hoch der pH-Wert dieser Lösung ist. Dafür schlägt man zuerst den pKs-Wert
der Salzsäure nach:

Man sieht, dass der pKs-Wert unter 1 liegt und Salzsäure damit eine starke Säure ist. Deshalb können wir die obig genannten, vereinfachenden Annahmen machen und den pH Wert folgendermaßen berechnen:

Es ergibt sich, dass der pH-Wert hier 0 ist.
pH-Wert berechnen schwache Säuren
Neben den starken Säuren gibt es auch noch die schwachen Säuren. Diese kennzeichnen sich dadurch, dass das Gleichgewicht bei der Säure-Base Reaktion mit Wasser fast vollständig auf der Eduktseite liegt:

Das gilt vor allem für Säuren, die einen pKs-Wert zwischen 4,5 und 9 haben. Ein Beispiel dafür wäre Essigsäure. Jedoch kann man hier nicht mehr die stark vereinfachenden Annahmen der starken Säuren treffen.
pH Wert berechnen schwache Säuren Formel
Wenn man für schwache Säuren den pH Wert berechnen möchte, fängt man am besten beim Massenwirkungsgesetz für obige Gleichung an. Über dieses kann man quantitativ erfassen, wie weit das chemische Gleichgewicht auf der Seite der Oxoniumionen liegt. Fertig aufgestellt sieht es folgendermaßen aus:

Die Konzentration von Wasser kann man hierbei aufgrund seiner sehr hohen Konzentration im Vergleich zu den anderen gleich 1 setzen und damit rauskürzen.

Im nächsten Schritt kann man davon ausgehen, dass die Konzentration der Oxonium-Ionen der von der deprotonierten Säure entspricht, da ja bei der Reaktion immer sowohl ein Oxonium Teilchen als auch ein Teilchen der deprotonierten Säure entsteht. Dies erkennt man an den gleichen stöchiometrischen Koeffizienten in der Reaktionsgleichung. Berücksichtigt man dies, dann sieht die Formel so aus:
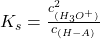
Nun kann man nach der Oxonium-Konzentration umstellen:

Nun nimmt man noch die Wurzel auf beiden Seiten:

Als letzten Schritt nimmt man noch den negativen dekadischen Logarithmus auf beiden Seiten:

Im letzten Schritt erkennt man noch den Ausdruck für den pH Wert auf der linken Seite und den Ausdruck für den pKs Wert auf der rechten Seite und setzt diese ein, wodurch sich ergibt:

Dabei nimmt man idealisierend an, dass die Restkonzentration der Säure  derjenigen am Anfang entspricht, da das Gleichgewicht ja sehr stark auf der Eduktseite liegt.
derjenigen am Anfang entspricht, da das Gleichgewicht ja sehr stark auf der Eduktseite liegt.
pH Wert berechnen schwache Säuren Beispiel
Ein häufiges Beispiel für schwache Säuren ist die Essigsäure, die einen pKs Wert von 4,76 hat. Nimmt man an, man würde 1 mol Essigsäure in Wasser lösen und möchte nun den pH Wert der Lösung berechnen. Dann kann man folgendermaßen vorgehen. Erst schreibt man sich die bekannten Daten auf:

Für obige Formel sind alle nötigen Parameter damit gegeben und man braucht nur noch einzusetzen:

pH Wert und pKs Wert
Wie du bereits gelernt hast, gibt der pKs Wert (im Englischen pKa Wert für a = acid) die Stärke einer Säure an. Je kleiner der pKs-Wert, desto stärker ist auch die Säure. Du berechnest ihn, indem du den negativen dekadischen Logarithmus der Säurekonstante  bildest.
bildest.

Wenn eine Säure (HA) und ihre korrespondierende Base (A–) in wässriger Lösung in den gleichen Konzentrationen vorkommen, dann sind auch pH-Wert und pKs Wert identisch. Das kannst du gut anhand der Henderson Hasselbalch Gleichung nachvollziehen.
In unserem Beitrag zum pKs Wert , haben wir für dich außerdem eine übersichtliche Tabelle mit den pKs-Werten gängiger Säuren zusammengestellt. Sie helfen dir bei den nachfolgenden Übungsaufgaben.
pH Wert berechnen — häufigste Fragen
(ausklappen)
pH Wert berechnen — häufigste Fragen
(ausklappen)-
Was sagt mir der pH-Wert über eine Lösung?Der pH-Wert zeigt dir, wie sauer oder basisch eine Lösung ist. Das hängt davon ab, wie hoch die Konzentration an Oxonium-Ionen
 ist, denn
ist, denn  . Bei 25°C gilt: pH < 7 sauer, pH > 7 basisch.
. Bei 25°C gilt: pH < 7 sauer, pH > 7 basisch.
-
Wann darf ich eine Säure als stark behandeln und welche pKs-Grenze gilt dafür?Du darfst eine Säure als stark behandeln, wenn ihr pKs-Wert kleiner als 1 ist. Dann liegt das Gleichgewicht praktisch vollständig auf der Produktseite, und die Säure gilt als vollständig dissoziiert. Beispiele dafür sind Salzsäure und Schwefelsäure.
-
Wie rechne ich den pH-Wert bei einer starken Säure aus?Bei einer starken Säure setzt du die Oxonium-Konzentration gleich der Säurekonzentration und rechnest
 . Das funktioniert, weil die Säure als vollständig dissoziiert angenommen wird und die Autoprotolyse des Wassers vernachlässigt wird. Beispiel:
. Das funktioniert, weil die Säure als vollständig dissoziiert angenommen wird und die Autoprotolyse des Wassers vernachlässigt wird. Beispiel:  .
.
-
Wie komme ich bei einer schwachen Säure von der Anfangskonzentration auf den pH-Wert?Für eine schwache Säure nutzt du
 mit der Anfangskonzentration
mit der Anfangskonzentration  . Das folgt aus dem Massenwirkungsgesetz und der Annahme, dass die Säure nur wenig reagiert. Beispiel: Essigsäure mit
. Das folgt aus dem Massenwirkungsgesetz und der Annahme, dass die Säure nur wenig reagiert. Beispiel: Essigsäure mit  und
und  ergibt
ergibt  .
.
-
Wie rechne ich den pH-Wert bei Schwefelsäure mit zwei Protonen?Bei Schwefelsäure rechnest du hier mit zwei abgegebenen Protonen und setzt
 . Dann gilt
. Dann gilt  , weil beide Deprotonierungsstufen wie starke Säuren behandelt werden. Für
, weil beide Deprotonierungsstufen wie starke Säuren behandelt werden. Für  ergibt das
ergibt das  .
.
pH Wert berechnen Aufgaben mit Lösungen
Aufgabe 1: Was ist der pH Wert einer 0,05 molaren Lösung von Ameisensäure?
Lösung Aufgabe 1: Als erstes sollte man wieder den pKs Wert nachschlagen, um die Säure in stark oder schwach einzuteilen. Dieser liegt bei Ameisensäure zwar bei 3,77 , aber man erhält mit der Formel für schwache Säuren noch ein akzeptables Ergebnis:

Aufgabe 2: Was ist der pH-Wert einer 1 molaren Lösung von Schwefelsäure?
Lösung Aufgabe 2: Als erstes sollte man für Schwefelsäure auch wieder den pKs Wert nachschlagen. Dieser liegt bei der ersten Protonierung bei -3 und bei der zweiten Deprotonierungsstufe bei 1,9. Zur Lösung nimmt man an, dass beide Deprotonierungsstufen über das Verhalten einer starken Säure beschrieben werden können. Daraus folgt, dass pro Mol Schwefelsäure, die reagiert, 2 Mol Oxonium-Ionen entstehen:

Deshalb ist der pH-Wert hier:

