Nuklid
In diesem Artikel stellen wir dir das Nuklid vor und zeigen was es damit auf sich hat. Du lernst seine verschiedenen Klassen kennen und die Bedeutung der Nuklidkarte, sowie die wissenschafltiche Schreibweise für derartige Elemente.
Schau dir auf jeden Fall noch das Video hierzu an. Darin ist für dich alles wichtige zur Thematik bereits audiovisuell aufbereitet.
Inhaltsübersicht
Nuklid einfach erklärt
Bei Nukliden handelt es sich um eine spezielle Art von Atomen, welche eindeutig durch ihre Massenzahl (Summe aus Neutronen und Protonen) und Kernladungszahl (Protonenzahl) charakterisiert sind. Wichtig ist zu Wissen das Isotope einen Spezialfall der Nuklide darstellen. Nuklide mit gleicher Protonenzahl gehören zum selben chemischen Element und werden Isotope genannt. Wegen der gleichen Kernladungszahl haben diese Isotope auch die gleiche Anzahl an Elektronen in der Atomhülle . Daher ist der Begriff Nuklid die Verallgemeinerung des älteren Begriffs Isotop.
Nuklide sind Atome, welche eindeutig durch ihre Massenzahl  und Kernladungszahl
und Kernladungszahl  charakterisiert sind.
charakterisiert sind.
Nuklid Schreibweise
Du wirst häufig in wissenschaftlichen Arbeiten Formeln finden, welche die Reaktionen
zwischen verschiedenen Elementen beschreiben. In solchen Formeln werden Nuklide mit  gekennzeichnet. Damit alle Informationen auf einen Blick ersichtlich sind gilt folgender Formalismus:
gekennzeichnet. Damit alle Informationen auf einen Blick ersichtlich sind gilt folgender Formalismus:

Das  bezeichnet das Element,
bezeichnet das Element,  steht für die Massenzahl,
steht für die Massenzahl,  die Kernladungszahl und ein etwaiges Hochzeichen
die Kernladungszahl und ein etwaiges Hochzeichen  steht für den Ionisationszustand
oder einen energetischen Anregungszustand. In der Kernphysik ist es gelegentlich auch üblich rechts unten die Neutronenzahl
steht für den Ionisationszustand
oder einen energetischen Anregungszustand. In der Kernphysik ist es gelegentlich auch üblich rechts unten die Neutronenzahl  des Kerns anzugeben.
des Kerns anzugeben.
Als Beispiel betrachte Cobalt-60:

Mit dieser Schreibweise erkennst du sofort, dass die Gesamtzahl der Protonen und Neutronen 60 beträgt. Davon sind 27 Protonen. Damit weißt du, dass das Nuklid 33 Neutronen hat.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Nuklid Klassen
Gelegentlich wirst du lesen, dass das Wort Isotop synonym für Nuklid benutzt wird. Allerdings handelt es sich bei Isotopen nur um einen speziellen Typ von Nuklid. Es gibt noch weitere.
-
Isotope:
Eine Gruppe von Nukliden mit gleicher Protonenzahl aber abweichender Neutronenzahl, wird als Isotop bezeichnet. ( )
) -
Isobare:
Eine Gruppe von Nukliden mit gleicher Massenzahl aber verschiedenen Kernladungszahlen, werden als Isobare bezeichnet. ( )
) -
Isotone:
Eine Gruppe von Nukliden mit gleicher Neutronenzahl aber abweichender Protonenzahl bezeichnet man als Isotone. ( )
) -
Isodiaphere:
Eine Gruppe von Nukliden mit gleichem Neutronenüberschuss bezeichnet man als Isodiaphere. ( )
)
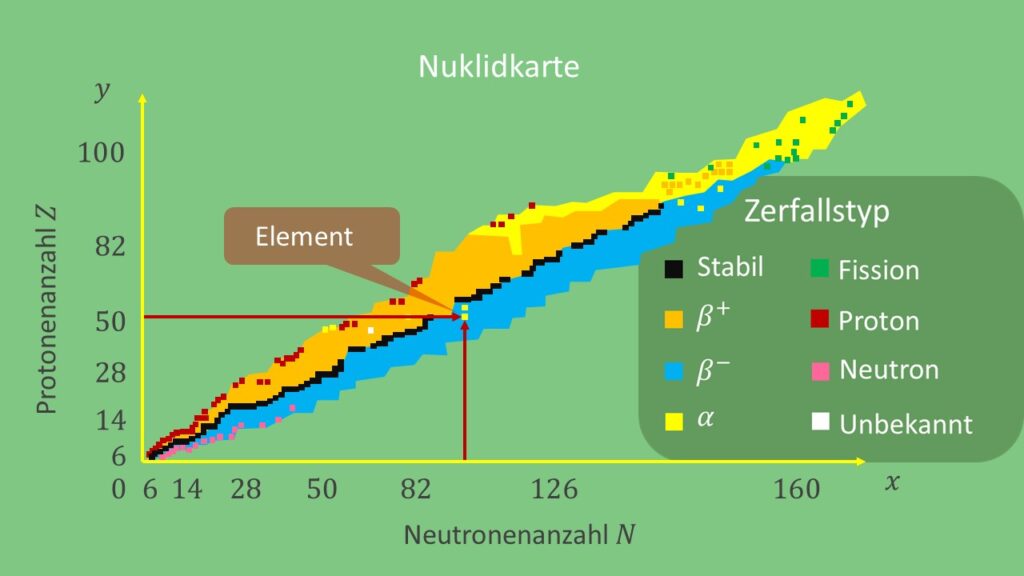
Nuklidkarte
Bei der Nuklidkarte handelt es sich um einen zweidimensionalen Graph. Eine Achse zeigt die Neutronenzahl, die andere die Protonenzahl des Atomkerns. Jeder Punkt auf dem Graph zeigt somit ein Nuklid. Damit erhält man mehr Einsicht in die Charakteristiken von Isotopen als mit dem Periodensystem . Letzteres zeigt nämlich nur die Elemente und nicht deren Isotope. Außerdem kann man auf einer Nuklidkarte die unterschiedlichen Zerfallsreihen ablesen. Das macht die Unterscheidung anhand der radioaktiven Eigenschaften der Nuklide möglich.
Eigenschaften und Stabilität
Nuklide bestehen aus Protonen und Neutronen, welche durch die starke Wechselwirkung zusammengehalten werden. Protonen sind positiv geladen und stoßen sich deshalb ab. Die neutralen Neutronen stabilisieren den Kern auf zwei Arten. Einerseits drückt ihre Anwesenheit die Protonen leicht auseinander, was die elektrostatische Abstoßung der Protonen reduziert. Andererseits wirken sie mit der anziehenden starken Kernkraft aufeinander und die Protonen. Damit ist ein oder mehr Neutronen notwendig um zwei oder mehr Protonen in einem Kern zu binden. Steigt die Zahl der Protonen, so muss das Verhältnis zwischen Neutronen und Protonen auch steigen, damit ein Kern stabil bleibt.
Daher sind meistens leichte Nuklide stabiler als schwere. Das schwerste stabile Nuklid mit der gleichen Zahl von Protonen zu Neutronen ist Kalzium-40 ( ). Bei schweren stabilen Nukliden wurde ein Überschuss an Neutronen beobachtet. Das heißt das die die Massenzahl
). Bei schweren stabilen Nukliden wurde ein Überschuss an Neutronen beobachtet. Das heißt das die die Massenzahl  abzüglich der Kernladungszahl
abzüglich der Kernladungszahl  , bzw. der Protonenzahl, einen höheren Wert als die Kernladungszahl ergeben hat.
, bzw. der Protonenzahl, einen höheren Wert als die Kernladungszahl ergeben hat.
Gerade und Ungerade Nukleonen-Zahlen
Aber nicht nur das Verhältnis von Protonen zu Neutronen ist wichtig für die Stabilität. Auch ob die Kernladungs– und Massenzahl gerade sind ist von Bedeutung. Ungerade Kernladungs– und Massenzahlen tendieren dazu geringere Kernbindungsenergien aufzuweisen, was dazu führt das ungerade Nuklide normalerweise instabiler sind. Die Konsequenz ist, dass instabile Isotope mit ungerader Kernladungs– und Massenzahl radioaktiv über den Beta–Zerfall , Elektroneneinfang oder spontane Fission zerfallen.
Die Mehrheit stabiler Nuklide hat gerade Neutronen– und Protonenzahlen. Stabile Nuklide mit ungerader Massenzahl  haben entweder eine gerade Protonen– und ungerade Neutronenzahl oder eine ungerade Protonen– und gerade Neutronenzahl. Stabile Nuklide mit ungeraden Protonen– und Neutronenzahlen sind sehr selten.
haben entweder eine gerade Protonen– und ungerade Neutronenzahl oder eine ungerade Protonen– und gerade Neutronenzahl. Stabile Nuklide mit ungeraden Protonen– und Neutronenzahlen sind sehr selten.
Nuklid Beispiele
In der Natur können Radionuklide in drei Kategorien eingeteilt werden. Die erste Kategorie wird durch Nuklide gebildet deren Halbwertszeit
 mindestens 2% des Alters der Erde entspricht, sogenannte ursprüngliche Nuklide. Diese sind die Überreste der Nukleosynthese, welche in Sternen stattfand bevor sich das Sonnensystem gebildet hat. Ein Beispiel ist das Isotop Uran-238 mit
mindestens 2% des Alters der Erde entspricht, sogenannte ursprüngliche Nuklide. Diese sind die Überreste der Nukleosynthese, welche in Sternen stattfand bevor sich das Sonnensystem gebildet hat. Ein Beispiel ist das Isotop Uran-238 mit  Jahre. Dieses Isotop kommt noch sehr häufig auf der Erde vor. Jedoch ist das kurzlebigere Uran-235 mit
Jahre. Dieses Isotop kommt noch sehr häufig auf der Erde vor. Jedoch ist das kurzlebigere Uran-235 mit  Jahre 138 Mal seltener. Bisher wurden insgesamt 34 solcher Nuklide entdeckt.
Jahre 138 Mal seltener. Bisher wurden insgesamt 34 solcher Nuklide entdeckt.
Die zweite Gruppe wird durch Nuklide gebildet, welche aus Zerfallsketten zweier der zuvor genannten langlebigen Nuklide entstehen, nämlich Uran und Thorium. Ein Beispiel ist das Isotop Radon-226 mit 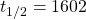 Jahre. Diese Nuklide haben eine zu kurze Halbwertszeit um zu den ursprünglichen Nukliden zu gehören und entstehen ausschließlich aus den Zerfallsketten dieser.
Jahre. Diese Nuklide haben eine zu kurze Halbwertszeit um zu den ursprünglichen Nukliden zu gehören und entstehen ausschließlich aus den Zerfallsketten dieser.
Die dritte Gruppe entsteht nicht bloß durch spontanen, radioaktiven Zerfall. Diese natürliche radioaktive Reaktion tritt durch die Wechselwirkung von Atomen mit natürlichen Neutronen oder kosmischer Strahlung ein. Ein Beispiel eines durch Bombardierung kosmischer Strahlung erzeugten Nuklids ist das Radiocarbon 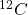 .
.