Nuklidkarte
In diesem Beitrag beschäftigen wir uns mit der Nuklidkarte. Wir erklären dir, was die Nuklidkarte ist, welchen Nutzen sie hat und wie du sie lesen kannst.
Du möchtest lieber ein Video über die Nuklidkarte sehen als einen Beitrag zu lesen? Wunderbar! Dann klicke doch auf Play und genieße unser animiertes Video zu diesem Thema.
Inhaltsübersicht
Nuklidkarte einfach erklärt
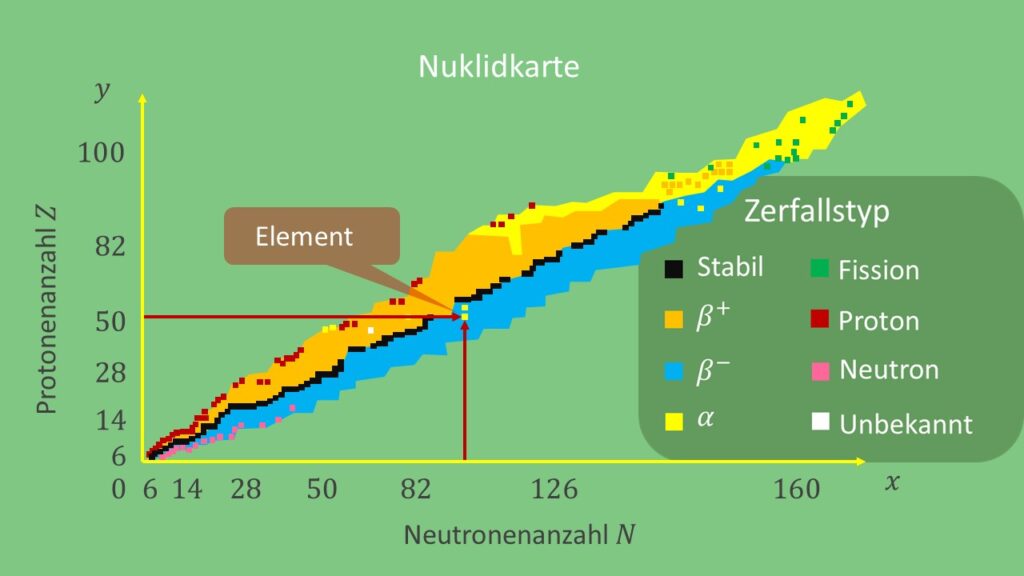
Die Bezeichnung Nuklidkarte (auch Isotopenkarte oder Isotopentafel) besteht aus zwei Bestandteilen, „Nuklid“ und „Karte“. Die Beschriftung „Nuklid“ soll dich darauf hinweisen, dass eine Nuklidkarte etwas mit Atomkernen zu tun hat. Die Beschriftung „Karte“ teilt dir mit, dass irgendwas in Bezug auf Atomkernen grafisch dargestellt wird. Aber was wird eigentlich genau dargestellt? Eine Landschaftskarte gibt dir für bestimmte Koordinaten  und
und  eine Höhe
eine Höhe  . Bei der Nuklidkarte sind die Koordinaten die Anzahl an Neutronen (die „
. Bei der Nuklidkarte sind die Koordinaten die Anzahl an Neutronen (die „ „-Achse) und Protonen (die „
„-Achse) und Protonen (die „ „-Achse) im Atomkern. An diesen Koordinaten findest du dann das Element (also die „Höhe“), dessen Atomkern die angegebene Anzahl an Nukleonen besitzt.
„-Achse) im Atomkern. An diesen Koordinaten findest du dann das Element (also die „Höhe“), dessen Atomkern die angegebene Anzahl an Nukleonen besitzt.
Die Nuklidkarte ist aber mächtiger als eine Landschaftskarte, weswegen sie für die Kernphysik das ist, was das Periodensystem der Elemente für die Chemie ist. Neben der grafischen Darstellung der Nuklide, kannst du an einer Nuklidkarte wichtige Eigenschaften, wie etwa die Halbwertszeit , die Zerfallsarten oder Zerfallseigenschaften, ablesen.
Was ist eine Nuklidkarte?
In diesem Abschnitt schauen wir uns die Nuklidkarte genauer an. Wir erklären dir, was genau du unter dem Begriff Nuklid verstehen und wie du die Nuklidkarte lesen kannst.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Nuklid
Wenn du dir irgendein Element aus dem Periodensystem rauspickst, woran kannst du festmachen, um welches Element es sich handelt? Genau, du untersuchst seinen Atomkern und zählst die Anzahl an Protonen und Neutronen. Nicht nur erfährst du damit, um welches Element es sich handelt, sondern auch, ob du ein Isotop des Elements vor dir liegen hast.
Die Bezeichnung Nuklid ist ein Fachausdruck für den Begriff Atomkern.
Eine Nuklidkarte hat als ihre Koordinaten die Anzahl an Neutronen (durch  abgekürzt) und die Anzahl an Protonen (durch
abgekürzt) und die Anzahl an Protonen (durch  abgekürzt), da ein Nuklid durch die Zahlen
abgekürzt), da ein Nuklid durch die Zahlen  und
und  bestimmt ist.
bestimmt ist.
 und
und  gegeben und Element wird gesucht
gegeben und Element wird gesucht
Eine Nuklidkarte kannst du wie eine Landschaftskarte lesen. Wenn du zum Beispiel die Anzahl an Neutronen und Protonen gegeben hast und du wissen möchtest zu welchem Element diese beiden Zahlen passen, dann gehst du auf der Nuklidkarte – beginnend vom Ursprung –  Schritte nach rechts und
Schritte nach rechts und  Schritte nach oben. Die Stelle, die du damit erreichst, ist mit einem Elementsymbol versehen. Dieses Symbol teilt dir dann mit, um welches chemische Element
es sich handelt.
Schritte nach oben. Die Stelle, die du damit erreichst, ist mit einem Elementsymbol versehen. Dieses Symbol teilt dir dann mit, um welches chemische Element
es sich handelt.
Lass uns ein Beispiel dafür anschauen. Nehmen wir dazu an, dass wir folgende Information gegeben haben
 und
und  .
.
Wir betrachten also ein Element, das in seinem Kern zwei Neutronen und zwei Protonen trägt. Um nun mit Hilfe der Nuklidkarte zu bestimmen, um welches Element es sich handelt, versetzen wir uns in den Ursprung der Karte. Von dort aus gehen wir zwei Schritte nach rechts (da  ) und zwei Schritte nach oben (da
) und zwei Schritte nach oben (da  ). Wir landen an einer Stelle, wo das Elementsymbol
). Wir landen an einer Stelle, wo das Elementsymbol  zu finden ist. Das bedeutet, dass die beiden Zahlen
zu finden ist. Das bedeutet, dass die beiden Zahlen  und
und  in diesem Beispiel zum Element Helium gehören.
in diesem Beispiel zum Element Helium gehören.
Element gegeben und  und
und  werden gesucht
werden gesucht
Nun könnte es sein, dass du ein Element vorgegeben hast und wissen möchtest, wie viele Neutronen und Protonen sich im Atomkern befinden. Dazu liest du die „ „-Koordinate und „
„-Koordinate und „ „-Koordinate der Stelle ab, wo sich das Element auf der Nuklidkarte befindet. Die „
„-Koordinate der Stelle ab, wo sich das Element auf der Nuklidkarte befindet. Die „ „-Koordinate ist dann die Anzahl an Neutronen und die „
„-Koordinate ist dann die Anzahl an Neutronen und die „ „-Koordinate die Anzahl an Protonen.
„-Koordinate die Anzahl an Protonen.
Nehmen wir als Beispiel das Sauerstoffisotop  . Seine
. Seine  -Koordinate in der Nuklidkarte ist 10 und seine
-Koordinate in der Nuklidkarte ist 10 und seine  -Koordinate 8. Damit besitzt dieses Sauerstoffisotop 10 Neutronen und 8 Protonen im Kern. Die Zahl 18 im Symbol
-Koordinate 8. Damit besitzt dieses Sauerstoffisotop 10 Neutronen und 8 Protonen im Kern. Die Zahl 18 im Symbol  ist die Nukleonenzahl (auch Massenzahl) dieses Sauerstoffisotops und entspricht gerade der Summe aus
ist die Nukleonenzahl (auch Massenzahl) dieses Sauerstoffisotops und entspricht gerade der Summe aus  und
und  .
.
Hinweis: Es existieren auch Nuklidkarten, wo die Anzahl an Neutronen nach unten und die Anzahl an Protonen nach rechts aufgetragen wird.
Unterschied zum Periodensystem
Wenn es nur um die Anzahl an Neutronen und Protonen geht, dann besitzt die Nuklidkarte im Vergleich zum Periodensystem den Vorteil, dass auf der Karte auch alle bekannten Isotopen eines Elements dargestellt werden. Die Isotopenkarte enthält aber viel mehr Informationen als nur die Anzahl an Neutronen und Protonen. Du kannst zum Beispiel Informationen über die Halbwertszeit und die möglichen Zerfallsarten eines Atomkerns erhalten oder Einblick darin gewinnen, wie stabil ein bestimmter Atomkern ist.
Zerfallsreihen
In diesem Abschnitt schauen wir uns die unterschiedlichen Zerfallsarten, die es ermöglichen, dass ein instabiler Atomkern zu einem stabilen Atomkern wird. Wir zeigen dir zusätzlich, wie die unterschiedlichen Zerfallsarten in der Nuklidkarte dargestellt werden.
Alpha-Zerfall
Beim Alpha-Zerfall
(auch  -Zerfall) gibt der Atomkern zwei Neutronen und zwei Protonen ab. In der Isotopentafel bewegst du dich also – ausgehend vom Atomkern, welcher zerfällt – zwei Schritte nach links (da zwei Neutronen „verloren“ wurden) und zwei Schritte nach unten (da zwei Protonen „verloren“ wurden). Das folgende Bild zeigt den Alpha-Zerfall in der Isotopentafel.
-Zerfall) gibt der Atomkern zwei Neutronen und zwei Protonen ab. In der Isotopentafel bewegst du dich also – ausgehend vom Atomkern, welcher zerfällt – zwei Schritte nach links (da zwei Neutronen „verloren“ wurden) und zwei Schritte nach unten (da zwei Protonen „verloren“ wurden). Das folgende Bild zeigt den Alpha-Zerfall in der Isotopentafel.
Beta-Zerfall
Beim Beta-Zerfall
(auch  -Zerfall) wird zwischen dem Beta-Minus (
-Zerfall) wird zwischen dem Beta-Minus ( ) und dem Beta-Plus (
) und dem Beta-Plus ( ) Zerfall unterschieden. Beim
) Zerfall unterschieden. Beim  -Zerfall verliert der Atomkern ein Neutron und gewinnt dabei ein Proton. Du bewegst dich also in der Karte einen Schritt nach links und einen Schritt nach oben. Beim
-Zerfall verliert der Atomkern ein Neutron und gewinnt dabei ein Proton. Du bewegst dich also in der Karte einen Schritt nach links und einen Schritt nach oben. Beim  -Zerfall gewinnt der Atomkern ein Neutron, verliert aber dabei ein Proton. In der Isotopentafel bewegst du dich daher einen Schritt nach unten und einen Schritt nach rechts. Das folgende Bild illustriert beide Zerfallsarten in der Isotopentafel.
-Zerfall gewinnt der Atomkern ein Neutron, verliert aber dabei ein Proton. In der Isotopentafel bewegst du dich daher einen Schritt nach unten und einen Schritt nach rechts. Das folgende Bild illustriert beide Zerfallsarten in der Isotopentafel.
Deutung in der Nuklidkarte
In der Isotopenkarte wird meist farblich kenntlich gemacht, welche Zerfallsprozesse ein Atomkern unternehmen kann. Ziel des Atomkerns ist es, durch mehrere Zerfallsprozesse in einen stabilen Zustand zu gelangen. Häufig werden die stabilen Kerne in der Karte schwarz dargestellt.