Carbonat
Was ist Carbonat und wie sieht das Carbonat-Ion aus? Hier und im Video erklären wir die die Carbonate mit ihren wichtigsten Eigenschaften und Reaktionen!
Inhaltsübersicht
Carbonat einfach erklärt
Carbonate sind die Salze, die bei der Dissoziation , also Spaltung, von Kohlensäure (H2CO3) entstehen. Die allgemeine Formel der Carbonate lautet MxCO3, denn sie bestehen aus einem Metall-Ion und einem Carbonat-Ion (CO32-). Dabei wird zwischen primären Carbonaten (Hydrogencarbonate) und sekundären Carbonaten unterschieden.
Die primären Carbonate enthalten ein Wasserstoffatom und haben die allgemeine Formel MHCO3.
Die sekundären Carbonate haben die allgemeine Formel M2CO3 — enthalten also kein Wasserstoff. Das CO32- ist dabei das Carbonat-Ion. Das M steht für ein im Salz enthaltenes Metall-Ion.
Hierbei kann das Carbonat-Ion Bindungen mit unterschiedlichen Metall-Ionen eingehen. So gibt es beispielsweise Calciumcarbonat oder Natriumhydrogencarbonat.
Carbonat Eigenschaften
Hier haben wir dir einige wichtige Eigenschaften von Carbonaten zusammengefasst:
- In der Regel sind Carbonate farb- und geruchlos. Durch eine Bindung mit einem Metall kann sich das allerdings ändern.
- Carbonate bilden mit Metallen ionische Salze, die bei Raumtemperatur als kristalline Feststoffe vorliegen.
- In Wasser sind nur die Alkalicarbonate gut löslich, alle anderen Carbonate sind schwer wasserlöslich. Dadurch können Metallionen in wässriger Lösung mit Alkalicarbonaten ausgefällt werden.
- Beim Erhitzen zerfallen die Carbonate zu CO2 und Metalloxiden.
- Das chemische Gleichgewicht der Kohlensäure in wässriger Lösung siehst du in der folgenden Gleichung: CO2 + H2O ⇌ H2CO3. Das Gleichgewicht liegt dabei allerdings sehr stark auf der linken Seite (Eduktseite).
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Reaktionen von Carbonaten
Einige der Eigenschaften von Carbonaten kannst du im Folgenden an Beispielreaktionen beobachten:
Dissoziation in Wasser
Alkalicarbonate, wie zum Beispiel das Magnesiumcarbonat (MgCO3), dissoziieren in Wasser:
MgCO3  Mg2+ + CO32-
Mg2+ + CO32-
Hierbei entstehen das Magnesiumkation Mg2+ und ein Carbonat-Ion.
Herstellung von Branntkalk durch Kalkbrennen
Metallcarbonate zerfallen (mit Ausnahme der schmelzenden Alkalicarbonate) beim Erhitzen. Den Prozess des Zerfalls nennst du auch Calcinieren. Dabei entstehen CO2 und das jeweilige Metalloxid MO. Diese Reaktion mit Calcium kannst du verwenden, um Branntkalk/Calciumoxid (CaO) durch Kalkbrennen bei 900 bis 1200 °C herzustellen:
CaCO3  CaO + CO2
CaO + CO2
Herstellung von Soda durch das Solvay-Verfahren
Soda, also Natriumcarbonat (Na2CO3), wird durch das sogenannte Solvay-Verfahren hergestellt. Dabei werden im ersten Schritt Ammoniak und Kohlendioxid in eine gesättigte Natriumchloridlösung (NaCl) eingeleitet. Dadurch entsteht das schwerlösliche Natriumhydrogencarbonat (NaHCO3), auch bekannt als Natron:
2 NaCl + 2 NH3 + 2 H2O + 2 CO2  2 NaHCO3 + 2 NH4Cl
2 NaHCO3 + 2 NH4Cl
Im zweiten Schritt kannst du durch Erhitzen schließlich Soda/Natriumcarbonat (Na2CO3) gewinnen:
2 NaHCO3  Na2CO3 + CO2 + H2O
Na2CO3 + CO2 + H2O
Herstellung weiterer Carbonate
Weitere Carbonate werden hergestellt, indem Kohlendioxid in die jeweilige alkalische Hydroxid-Lösung eingeleitet wird, zum Beispiel Kaliumcarbonat K2CO3:
2 KOH + CO2 ⇌ K2CO3 + H2O
Carbonat Entstehung
Bei der Dissoziation der Kohlensäure (H2CO3) entstehen Carbonat-Anionen. Da Kohlensäure 2 Wasserstoffatome besitzt und somit eine zweiprotonige Säure ist, dissoziiert sie in wässriger Lösung in 2 Schritten:
- Dissoziationsschritt: CO2 + H2O ⇌ H+ + HCO3–
- Dissoziationsschritt: HCO3– ⇌ H+ + CO32-
Wichtig ist hierbei, dass Kohlensäure in Wasser instabil ist. Deswegen enthält die Lösung statt der Kohlensäure fast ausschließlich CO2-Moleküle.
Reagiert Kohlensäure mit einem Metall oder auch Metalloxid entstehen Carbonate. Hier ist eine solche Reaktion am Beispiel der Magnesiumcarbonat-Herstellung gezeigt:
Mg + H2CO3  MgCO3 + H2
MgCO3 + H2
Carbonat-Ion
Hier die wichtigsten Informationen zum Carbonat-Ion auf einen Blick:
- Das Carbonat-Ion CO32- (auch Carbonat-Anion) entsteht bei der Dissoziation von Kohlensäure und kann mit Metallen, wie Alkalimetallen, Salze bilden. Diese können in Wasser schließlich wieder dissoziieren.
- Bei dem Carbonat-Ion handelt sich um ein symmetrisches, trigonal-planares und mesomerie -stabilisiertes Anion. Das bedeutet, dass die Liganden in einem flachen Dreieck um das Zentralatom angeordnet sind und das Molekül durch mesomere Grenzstrukturen stabilisiert ist.
- Das enthaltene Kohlenstoffatom hat drei sp2-Hybridorbitale
und ein nicht hybridisiertes p-Orbital
. Die einzelne
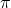 -Bindung ist delokalisiert, geht also über alle Atome des Carbonat-Ions.
-Bindung ist delokalisiert, geht also über alle Atome des Carbonat-Ions. - Carbonat-Ionen können an einer Säure-Base-Reaktion beteiligt sein.
- Bei der Reaktion mit Wasser entstehen Hydrogencarbonationen HCO3– und Hydroxidionen OH– durch folgende Reaktion:
CO32- + H2O ⇌ HCO3– + OH–
Carbonat Nachweis
Eine Möglichkeit Carbonat nachzuweisen ist das Einleiten von Kohlendioxid in eine alkalische Hydroxid-Lösung, denn dabei wird das entstehende Carbonat ausgefällt.
Lässt du Kohlendioxid in eine Bariumhydroxid-Lösung (Ba(OH)2), dann entsteht eine weiße Trübung, das Bariumcarbonat BaCO3.
Ba(OH)2 (aq) + CO2 (g)  BaCO3
BaCO3  + H2O (l)
+ H2O (l)
Eine weitere Möglichkeit Carbonat-Ionen nachzuweisen ist die Zugabe von Salzsäure (HCl). Dabei bildet sich das Gas Kohlendioxid, was du an der Blasenbildung erkennen kannst.
CO32- + 2 HCl  CO2
CO2  + 2 Cl– + H2O
+ 2 Cl– + H2O
Wichtige Carbonate
Es gibt viele verschiedene Carbonate. Hier haben wir dir die wichtigsten einmal aufgelistet:
- Calciumcarbonat (z. B. in Kalkstein, Kalkspat, Marmor)
- Natriumcarbonat (Soda)
- Natriumhydrogencarbonat (Natron)
- Kaliumcarbonat (Pottasche)
- Magnesiumcarbonat
- Ammoniumhydrogencarbonat (Hirschhornsalz)
Carbonat Vorkommen und Verwendung
Die verschiedenen Carbonate kommen an unterschiedlichen Orten vor und auch ihre Verwendung unterscheidet sich:
- Calciumcarbonat ist zum Beispiel in Calcit enthalten. Dieses ist auch unter dem Namen Kalkspat bekannt. Es wird auch tatsächlich hauptsächlich aus der Natur gewonnen. Während die chemische Industrie Calciumcarbonat für weitere Herstellungsprozesse benötigt, benutzt die Bauindustrie es für die Grundstoffe Branntkalk und Mörtel.
- Auch Natriumcarbonat kannst du in Seen finden, zum Beispiel in Karlsbad in den Heilquellen. Es wird vor allem in der Glasindustrie verwendet, aber auch als Zwischenprodukt in der chemischen Industrie. Es wird beispielsweise zur Herstellung von Wasch- oder Bleichmitteln gebraucht.
- Natriumhydrogencarbonat kommt vor allem im Mineral Nahcolit vor und wird als Natron für die Produktion von Back- oder Brausepulver verwendet, aber auch als Bleichmittel oder zur Hitzeabsorption kommt es zum Einsatz. Dabei spielt es in verschiedenen Bereichen, wie der Lebensmittelindustrie, der Medizin und der Landwirtschaft, aber auch der Luftfahrt- und der Umwelttechnik, eine große Rolle.
- Kaliumcarbonat kannst du in Holzasche oder in Salzseen, wie dem Toten Meer, finden. Es wird vor allem für die Herstellung von Seifen, Farben und Düngemitteln sowie als Zusatzstoff bei der Glasherstellung verwendet.
Kohlensäure
Kohlensäure ist eine anorganische Säure, die in vielen Erfrischungsgetränken vorkommt. Warum sie aber auch im Körper eine wichtige Rolle spielt, erfährst du in unserem Video dazu!

