Methanal (Formaldehyd)
Methanal nennst du auch Formaldehyd. Hier und im Video erfährst du welche Eigenschaften Methanal hat und wofür du es verwendest.
Inhaltsübersicht
Was ist Methanal (Formaldehyd)?
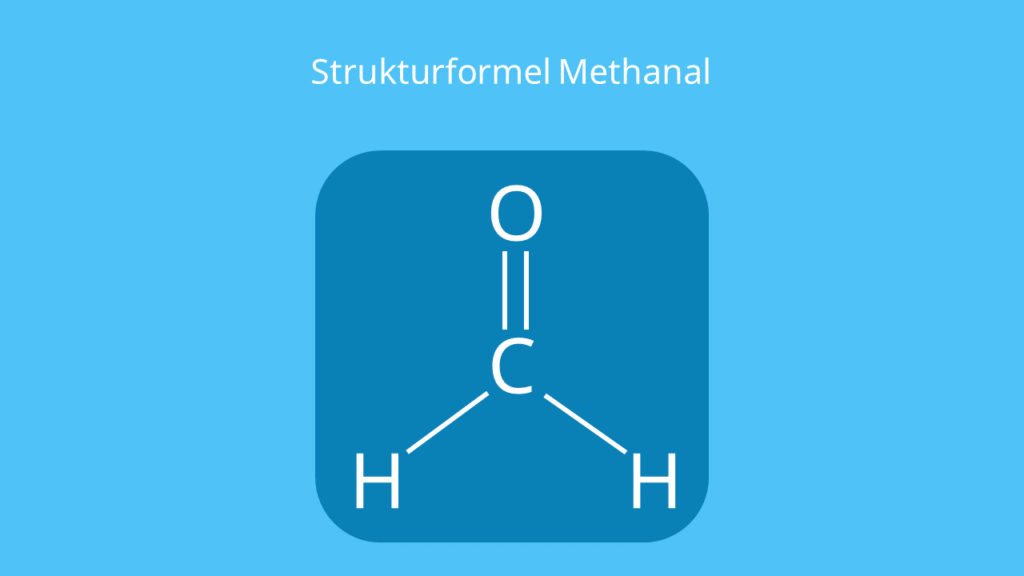
Methanal ist ein Aldehyd. Das kannst du dir leicht merken, da du es auch Formaldehyd nennst. Du erkennst die Aldehydgruppe (–CHO) an der Strukturformel vom Methanal. Die Summenformel lautet CH2O (auch HCHO oder H2CO).
Es handelt sich bei der Verbindung um das ‚einfachste‘ Aldehyd , da es nur aus einer Aldehydgruppe und einem Wasserstoffatom (H) besteht.
Obwohl die Verbindung giftig ist, ist Formaldehyd eine der meisthergestellten Chemikalien. Es ist nämlich ein wichtiger Ausgangsstoff zur Produktion vieler anderer Verbindungen (z.B. Harze, Alkohole).
Methanal Eigenschaften
Im Folgenden haben wir dir einige chemische und physikalische Eigenschaften der Verbindung aufgelistet:
- Molare Masse: Die molare Masse von CH2O beträgt 30,03 g/mol.
- Dichte : Die Verbindung hat eine Dichte von 0,815 g/cm3.
- Schmelzpunkt: Bei -117°C schmilzt CH2O.
- Siedepunkt : Methanal siedet bei -19°C.
- Aussehen und Geruch: Formaldehyd ist ein farbloses, stechend riechendes Gas.
- Löslichkeit: Es ist gut in Wasser (H2O), Ethanol (CH3CH2OH) und Diethylether ((C2H5)2O) löslich.
- Entzündbarkeit: Methanal ist sehr leicht entzündlich.
- Besonderheit: Das Gas ist giftig und verfügt über eine extrem hohe Reaktionsfähigkeit. So bildet es mit anderen Stoffen teilweise noch giftigere Verbindungen. Außerdem wirkt es zerstörend auf Eiweiße, wodurch es für den menschlichen Körper gefährlich werden kann.
Reaktionen
Eine sehr toxische Verbindung, die durch Formaldehyd hergestellt werden kann, ist Bischlormethylether (C2H4Cl2O). Sie ist leicht entzündlich und krebserregend. Um sie herzustellen, lässt du CH2O mit Chlorwasserstoff (HCl) reagieren.
Lagert sich Wasserstoff (H) an Methanal an, entsteht der Alkohol Methanol (CH3OH) — eine weitere giftige Verbindung.
Methanal kann aber nicht nur als Gas, sondern auch in einer Lösung vorliegen. Kommen in eine verdünnte Formaldehydlösung (Formalinlösung) Verunreinigungen, neigt CH2O zur Polymerisation . Dabei bildet sich dann eine Verbindung, die du Paraformaldehyd nennst.
Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Formaldehyd Giftigkeit
Bereits geringe Konzentrationen des Gases können deine Atemorgane, Augen, Nase und Kehle reizen. Eine größere Menge Formaldehyd (10 ppm) kann zusätzlich deine Schleimhäute reizen und Husten verursachen. Steigt die Konzentration des Gases auf 30 ppm, kann es zu schweren Lungenentzündungen und Lungenödemen kommen — dann besteht Lebensgefahr!
Solltest du über einen längeren Zeitraum mit der Verbindung in Berührung kommen, merkst du das an Symptomen wie Schlaflosigkeit, Kopfschmerzen, Antriebslosigkeit oder Bronchitis. Oft treten auch allergische Reaktionen auf. Außerdem steht Methanal im Verdacht, krebserregend zu sein.
Besonders gefährlich daran ist, dass Formaldehyd Proteine denaturieren kann. Das bedeutet, dass die Struktur des Proteins verändert wird. Methanal kann beispielsweise Netzhautproteine denaturieren, was zur Erblindung führen kann!
Formaldehyd Entsorgung
Deshalb ist es wichtig, dass du bei der Arbeit mit Formaldehyd eine Schutzausrüstung trägst und auf die richtige Entsorgung achtest. Kleinere Mengen kannst du mit Wasser verdünnen und ins Abwasser geben. Bei einer größeren Menge musst du das Aldehyd in dicht verschließbaren Behältern für organische Abfälle entsorgen.
Formaldehyd Vorkommen
Tatsächlich kommt die Verbindung trotz ihrer giftigen Wirkung vielseitig in der Natur vor. Einige Organismen stellen Formaldehyd sogar selbst her. So findest du es beispielsweise als Zwischenprodukt des Stoffwechsels in den Zellen von Säugetieren .
Aber auch in Früchten, wie Äpfeln oder Weintrauben, kommt Methanal natürlich vor. Dadurch gelangt die giftige Verbindung auch in den menschlichen Körper. Allerdings beinhalten die Nahrungsmittel nur sehr wenig Methanal, sodass wir es verstoffwechseln können.
Bedenklicher ist die Menge, die bei unvollständigen Verbrennungen (z.B. durch Autoabgase, Zigarettenrauch) entsteht. Werden 10 Zigaretten in einem 10 m3 Raum geraucht, wird der Innenraum-Grenzwert von 0,1 ppm überschritten. Auch die Bildung des Aldehyds beim Verbrennen von Kraftstoff in Fahrzeugen ist kritisch. Gerade an Verkehrsknotenpunkten sammelt sich so extrem viel Methanal an.
Selbst in der Atmosphäre entsteht CH2O — und zwar durch Photooxidation. Darunter verstehst du eine Oxidation , die durch Licht ausgelöst wird. So begleitet uns Formaldehyd täglich als unerwünschtes Nebenprodukt.
Formaldehyd Verwendung
Methanal gehört zu den wichtigsten organischen Grundstoffen in der chemischen Industrie. Wir haben für dich einige Beispiele für die Verwendung des Gases aufgelistet:
-
Synthesestoff: Mithilfe von Formaldehyd können zahlreiche Verbindungen hergestellt werden. Dazu zählen beispielsweise:
- Phenoplasten: Darunter verstehst du Harze, die aus Phenol und Methanal aufgebaut sind.
- Aminoplasten: Reagiert CH2O mit Harnstoff (CH4N2O), entstehen Aminoplasten.
- Polyoxymethylen: Der Thermoplast zeichnet sich durch eine hohe Festigkeit und Härte aus.
- Desinfektionsmittel: Zum Desinfizieren von Flächen ist Methanal auch heutzutage noch ein wichtiger Bestandteil. Um keine gesundheitlichen Schäden hervorzurufen, darf das Aldehyd nur in gewissen Mengen in Desinfektionsmitteln vorhanden sein.
- Kosmetik: Hier wird Formaldehyd als Konservierungsmittel, also zur Haltbarmachung von Stoffen, genutzt. Da die Verbindung hautreizend wirken kann, gilt das aber als problematisch.
- Medizin: In dem Bereich wird Formalinlösung dazu verwendet, Leichen zu konservieren. Aber auch andere anatomische und biologische Präparate werden damit haltbar gemacht.
Methanal Herstellung
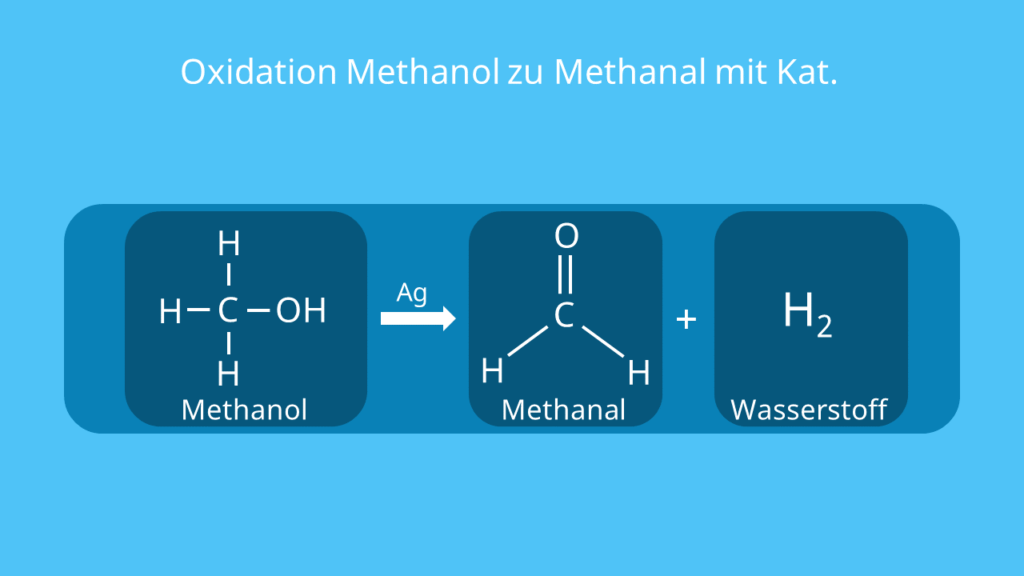
Du kannst das Aldehyd im Labor gewinnen, indem du Methanol (CH3OH) oxidierst. Dafür gibt es unterschiedliche Möglichkeiten. Eine Option ist eine Oxidation mithilfe eines Katalysators (Reaktionsbeschleunigers), wie Silber (Ag).
Eine andere Möglichkeit ist die Oxidation mithilfe eines Oxidationsmittels , wie Kupfer(II)-oxid (CuO). Bei der Reaktion entstehen dann neben dem Aldehyd zusätzlich das chemische Element Kupfer (Cu) und Wasser (H2O).
Beide Methoden haben Vor- und Nachteile. So musst du bei der katalytischen Oxidation mit Silber häufiger den Katalysator austauschen. Im Gegenzug hat die Formaldehydlösung aber schließlich eine höhere Qualität als bei der Oxidation durch Kupferoxid.
Formaldehyd Nachweis
Um das Aldehyd nachzuweisen, wird meist die sogenannte Schiff’sche Probe verwendet. Hier erfolgt der Nachweis mithilfe einer farblosen fuchsinschwefligen Säure. Ändert sich die Farbe von farblos zu violett, ist der Nachweis positiv — dann weißt du, dass Methanal in deiner Probe vorhanden ist.
Eine andere Möglichkeit, Aldehyde nachzuweisen ist die Tollensprobe.
Wie hier der Nachweis funktioniert, erklären wir dir im nächsten Video, bis gleich!